Articles
- Page Path
- HOME > J Korean Acad Nurs > Volume 49(4); 2019 > Article
- Original Article A Structural Model for Chemotherapy Related Cognitive Impairment and Quality of Life in Breast Cancer Patients
- Jung Ran Lee1, Pok Ja Oh2
-
Journal of Korean Academy of Nursing 2019;49(4):375-385.
DOI: https://doi.org/10.4040/jkan.2019.49.4.375
Published online: January 15, 2019
2Department of Nursing, Sahmyook University, Seoul,
Abstract
This study aimed to develop and test a structural model for chemotherapy-related cognitive impairment of breast cancer patients based on a literature review and Hess and Insel's chemotherapy-related cognitive change model.
The Participants consisted of 250 patients who were ≥19 years of age. The assessment tools included the Menopause Rating Scale, Symptom Experience Scale, Hospital Anxiety and Depression Scale, Everyday Cognition, and Functional Assessment of Cancer Therapy-Breast Cancer. Data were analyzed using the SPSS 21.0 and AMOS 21.0 programs.
The modified model was a good fit for the data. The model fit indices were χ 2=423.18 (
These results suggest that chemotherapy-related toxicity is highly associated with cognitive decline and quality of life in women with breast cancer. Depression and anxiety increased vulnerability to cognitive impairment after chemotherapy. Nursing intervention is needed to relieve chemotherapy-related toxicity and psychological factor as well as cognitive decline for quality of life in patients undergoing chemotherapy.
Published online Aug 29, 2019.
https://doi.org/10.4040/jkan.2019.49.4.375
Abstract
Purpose
This study aimed to develop and test a structural model for chemotherapy-related cognitive impairment of breast cancer patients based on a literature review and Hess and Insel's chemotherapy-related cognitive change model.
Methods
The Participants consisted of 250 patients who were ≥19 years of age. The assessment tools included the Menopause Rating Scale, Symptom Experience Scale, Hospital Anxiety and Depression Scale, Everyday Cognition, and Functional Assessment of Cancer Therapy-Breast Cancer. Data were analyzed using the SPSS 21.0 and AMOS 21.0 programs.
Results
The modified model was a good fit for the data. The model fit indices were χ2=423.18 (p<.001), χ2/df=3.38, CFI=.91, NFI=.91, TLI=.89, SRMR=.05, RMSEA=.09, and AIC=515.18. Chemotherapy-related cognitive impairment was directly influenced by menopausal symptoms (β=.38, p=.002), depression and anxiety (β=.25, p=.002), and symptom experiences (β=.19, p=.012). These predictors explained 47.7% of the variance in chemotherapy-related cognitive impairment. Depression and anxiety mediated the relations among menopausal symptoms, symptom experiences, and with chemotherapy related cognitive impairment. Depression and anxiety (β=−.51, p=.001), symptom experiences (β=−.27, p=.001), menopausal symptoms (β=−.22, p=.008), and chemotherapy-related cognitive impairment (β=−.15, p=.024) had direct effects on the quality of life and these variables explained 91.3%.
Conclusion
These results suggest that chemotherapy-related toxicity is highly associated with cognitive decline and quality of life in women with breast cancer. Depression and anxiety increased vulnerability to cognitive impairment after chemotherapy. Nursing intervention is needed to relieve chemotherapy-related toxicity and psychological factor as well as cognitive decline for quality of life in patients undergoing chemotherapy.
서 론
1. 연구의 필요성
유방암은 전 세계적으로 빠르게 증가되고 있는 질환으로, 국내 여성에게 발생하는 전체 암 중 갑상선암에 이어 두 번째로 흔하며 5년 상대생존율이 최근 2008~2012년 기준 91.3%로 세계 최고의 수준을 보이고 있다[1]. 유방암의 치료는 수술, 항암화학요법, 표적치료, 항호르몬요법 및 방사선치료 등이 있으며, 이 중 보조적 항암화학요법은 대부분의 유방암 환자에게 적용되고 있다. 항암화학요법은 유방암의 재발감소와 생존율은 향상시켰으나 폐경, 인지장애 및 성기능저하 등의 생리적인 부작용을 초래하여 유방암 생존자의 삶의 질을 저하시킨다[2].
항암화학요법의 부작용 중 항암화학요법으로 초래되는 인지손상(chemotherapy related cognitive impairment [CRCI])은 주로 기억력, 집중력 및 사고력의 저하가 있으며, 유방암 생존자의 16~75%에서 발생한다[3]. 유방암 환자가 경험하는 인지기능의 변화는 주로 쉽게 잊어버리거나 집중력이 감퇴되는 등 경미하게 발생하기 때문에 다른 신체적 증상에 가려져 임상에서 간과되고 있으나[4], 그대로 방치되면 일상생활과 직무수행에 어려움을 초래하여 삶의 질에 부정적인 영향을 준다[2]. 유방암 환자에게 항암화학요법 관련 인지기능 저하를 초래하는 약물은 대사길항제(예, 5-FU, methotrexate)와 알킬화제(cyclophosphamide, carmustine) 및 파클리탁셀(paclitaxel) 등이다[4].
항암화학요법 관련 인지기능 손상은 고용량의 항암화학요법[5] 장기간의 암 치료로 인한 혈관손상 및 염증반응, 신경세포의 직접적인 손상[6], 그리고 호르몬요법으로 인한 에스트로겐의 결핍[7] 등 다양한 요인들의 상호작용으로 발생한다고 보고되었다.
항암화학요법 관련 인지기능 변화 모형[8]에서는 암 치료 요인(항암제 치료 용량 등), 치료와 관련된 독성 요인(빈혈, 암 증상)과 심리적 요인(우울과 불안)이 인지기능에 영향을 미치며, 이는 암 환자의 삶의 질에 영향을 미친다고 하였다. 또한 항암화학요법 관련 인지기능에 대한 고찰 연구[9]에서는 암환자의 인지기능에 치료관련요인(호르몬제제), 증상요인(피로) 및 심리요인(우울과 불안)등이 관련된다고 제시하였다. Weiss [10]의 연구에서는 폐경으로 인한 여성호르몬의 급격한 감소는 혈액순환에 영향을 미치며, 기억력과 집중력 감퇴 등의 인지기능장애를 유발하고, 갱년기 증상은 불안이나 우울, 스트레스를 유발하여 유방암 생존자의 삶의 질을 저하시킨다고 하였다[11, 12]. 이러한 선행연구들은 항암화학요법 관련 인지기능 손상을 통합적으로 설명하는데 제한적이다. 따라서 본 연구에서는 이들 요인들을 포함하여 유방암 환자의 항암화학요법 관련 인지기능 변화를 설명하고자 질병·치료관련요인으로 항암화학요법 관련 독성인 빈혈과 암 증상경험, 호르몬 요인으로 갱년기 증상, 심리적 요인으로 우울과 불안을 선정하였다.
항암화학요법으로 인한 빈혈은 암 치료와 관련하여 발생하는 흔한 부작용으로 피로를 유발하고 뇌혈류의 산소공급을 감소시켜 인지기능에 영향을 줄 수 있다[8]. 본 연구에서 증상경험은 유방암 환자가 치료과정 동안에 경험하는 신체적 부작용으로 피로, 통증, 식욕 식욕부진, 수면양상의 변화, 변비, 설사, 외모의 변화, 오심, 구토 등을 포함하였다. 항암화학요법은 항암제의 독성으로 조기에 난포세포를 감소시키고, 에스트로겐 호르몬의 급격한 감소로 인해 갱년기 증상을 심화시켜 인지기능을 저하시킨다[9, 13]. 이러한 갱년기 증상이 유방암 생존자의 삶의 질을 저하시키는 중요한 변수로 제시되고 있다[14]. 또한 유방암 환자가 암 진단 자체로 흔히 경험하는 우울은 인지기능 장애에 영향을 미치며, 불안은 우울증상과 공존하는데, 불안수준이 높으면 인지조절 기능에 영향을 미친다[15].
이상의 연구결과들을 볼 때 유방암 환자의 항암화학요법 관련 인지기능과 삶의 질을 증진시키기 위해서는 암 치료 관련 증상경험이나 우울과 불안 등의 심리적 요인을 완화시키는 것이 중요하다.
이에 본 연구에서는 Hess와 Insel [8]의 항암화학요법 관련 인지기능 변화 모형과 선행연구[9, 10]를 토대로 유방암 환자의 항암화학요법 관련 인지기능 변화와 삶의 질에 대한 가설적 모형을 구축하고 그 요인들 간의 관계를 검증하여 간호중재를 개발하기 위한 기틀을 제공하고자 하였다.
2. 연구의 목적
1) 유방암환자의 항암화학요법 관련 인지기능손상과 삶의 질에 대한 가설적 모형을 구축하고 모형의 적합성을 검정한다.
2) 항암화학요법 관련 인지기능손상과 삶의 질에 영향을 미치는 변인들 간의 상호간의 관계 및 영향력을 규명한다.
3. 연구의 개념적 기틀 및 가설적 모형
Hess와 Insel [8]의 항암화학요법 관련 인지기능변화 모형은 암환자의 인지기능 손상이 촉진요인(질병․치료관련 요인, 심리적 요인)과 조절요인(연령, 교육수준, 유전적 요인, 공존 신경 질환)의 영향을 받으며, 결과적으로 삶의 질에 부정적인 영향을 주는 것으로 설명한다. 또한 선행연구[9, 10]에서는 치료관련요인(여성호르몬 문제), 증상요인(피로) 및 심리요인이 인지기능에 관련이 있는 것으로 제시하고 있다.
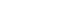
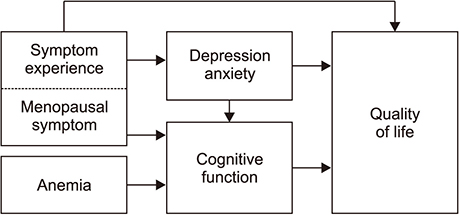
따라서 본 연구의 개념적 틀은 유방암 환자의 인지기능손상이 질병·치료관련요인으로 항암화학요법 관련 독성인 빈혈과 암 증상경험, 호르몬 요인으로 갱년기 증상, 심리적 요인으로 우울과 불안에 의해 통합적으로 영향을 받고 궁극적으로 삶의 질에 영향을 주는 것으로 설정하였다(Figure 1). 가설적 모형에서 외생변수는 빈혈, 증상경험 및 갱년기 증상이며, 내생변수는 우울과 불안, 인지기능 손상 및 삶의 질이다. 또한 우울과 불안은 외생변수(증상경험 및 갱년기 증상)와 인지기능손상의 관계에서 매개변수로, 인지기능손상은 이 변수들과 삶의 질의 관계에서 매개변수로 설정하였다(Figure 2A).
Figure 1
Conceptual framework of this study.
Figure 2
Hypothetical model and path diagram for the modified model. (A) Hypothetical model. (B) Path diagram for the modified model.
연구 방법
1. 연구 설계
본 연구는 항암화학요법 관련 인지기능 변화 모형[8]과 선행연구[9, 10]를 토대로 유방암 환자의 항암화학요법 관련 인지기능손상과 삶의 질을 설명하는 가설적 모형을 구축하고, 모형의 적합성과 가설을 검증하는 구조모형분석을 이용한 횡단적 조사연구이다.
2. 연구대상
대상자는 유방암으로 진단받은 후 서울시 소재 일개 암 전문 병원에서 인지기능장애를 초래한다고 보고된[4] 항암화학요법 CMF (Cyclophosphamide, Methotrexate, 5-Fluorouracil), AC (Adriamycin, Cyclophosphamide), AC+Genexol을 받았거나 받고 있는 19세 이상의 성인 환자, 서면으로 본 연구의 목적과 방법에 대한 설명을 듣고 자발적으로 참여를 수락한 자로 하였다. 제외기준은 인지기능에 영향을 미칠 수 있는 중추신경계 질환 병력이 있는 자, 중추신경계에 방사선 치료나 수술병력이 있는 자이다.
표본의 크기는 구조방정식 모형에서 관측변수 당 10~20배의 표본이 필요하며, 모수추정에 최대 우도법을 활용할 경우 일반적으로 200명이 적절하다는 근거에 따라[16] 본 연구에서는 관측변수가 19개이므로 250명을 연구대상으로 하였다.
3. 연구 도구
1) 빈혈
대상자의 전자의무기록을 검토하여 항암치료를 받기 전 검사된 1회의 혈액 내 헤모글로빈의 수치(g/dl)로 측정하였다.
2) 증상경험
증상경험은 Samarel 등[17]이 개발한 증상경험 측정도구 Symptom Experience Scale (SES)의 한국어판 도구로 조사 하였다[18]. SES는 피로, 오심, 통증, 식욕저하, 배변양상의 변화, 외모의 변화, 수면장애, 집중력 장애 등 동일한 8문항에 대해 빈도, 강도 및 고통의 3영역으로 측정하도록 구성되어 있다. 각 문항에 대하여 0점(전혀 그렇지 않았다)에서 4점(매우 그렇다)까지 5점으로 응답하도록 하여 점수가 높을수록 증상경험이 큰 것을 의미한다.
확인적 요인분석 결과 요인 부하량 .5이상 7문항과 .4이상 1문항으로 나타나 수렴타당도가 있는 것으로 나타났다. 본 도구의 신뢰도 Cronbach's α는 개발 당시 .94였으며, 본 연구에서는 .93이었다. SES 도구는 원저자로부터 사용 허락을 받았다.
3) 갱년기 증상
갱년기 증상은 Heinemann 등[19]이 개발한 Menopause Rating Scale (MRS)의 한국어판으로 조사하였다. MRS는 3개 하위영역, 11문항의 5점 척도로서 신체자율영역(4문항), 비뇨생식영역(3문항), 정신심리영역(4문항)으로 구성되어 있다. 각 문항에 대하여 0점(증상 없음)에서 4점(매우 심함)으로 응답하도록 하여 점수가 높을수록 갱년기 증상이 심함을 의미한다. 총점 0~4점은 갱년기 증상이 거의 없는 것이고, 5~7점은 경미한 정도, 8~15점은 중등도, 16점 이상은 갱년기 증상이 심한 것으로 평가한다.
확인적 요인분석 결과 요인 부하량이 .58~.88로 모든 문항이 갱년기 증상에 대해 수렴하여 도구의 적합성이 확인되었다. 개발 당시 도구의 신뢰도 Cronbach's α는 개발 당시 .86이었고, 본 연구에서는 .90이었다. MRS는 국제적으로 널리 사용되는 척도로서 http://www.menopause-
4) 우울과 불안
우울과 불안은 Zigmond와 Snaith [20]가 개발하고 Oh 등[21]이 한국어로 표준화한 Hospital Anxiety and Depression Scale (HADS)로 측정하였다. HADS는 개발당시 환자의 치료와 연관되어 흔히 발생되는 피로, 수면부족 등의 신체적 증상과 중복되지 않는 문항들로 구성되어 있어 환자 대상으로 우울과 불안을 파악하기 위해 흔히 사용되는 도구이다[20]. 총 14문항으로 우울 7문항, 불안 7문항이며, 각 문항에 대하여 0점(없음)에서 3점(심함)으로 응답하도록 하여 점수가 높을수록 증상이 심한 것을 의미한다. 0~7점은 우울 혹은 불안이 없는 상태, 8~10점은 경한 우울 혹은 불안, 11~21점은 중등도 이상의 우울 혹은 불안을 뜻한다. 도구의 신뢰도 Cronbach's α는 개발당시 우울이 .86, 불안이 .89였으며, 본 연구에서는 우울이 .87, 불안이 .78이었다. HADS는 저작권자인 Granada Learning Education Group으로부터 도구를 구입한 후 사용하였다.
5) 주관적 인지장애
주관적 인지장애는 Farias 등[22]이 개발한 Everyday Cognition (ECog) 측정도구를 Chung과 Cho [23]가 번안한 도구로 조사하였다. ECog은 기억, 언어, 실행기능 계획, 실행기능 조직, 실행기능 주의분배, 시공간 및 지각능력의 6개 하위영역으로 구성되어 있으며, 각 문항은 10년 전과 비교하여 인지기능이 1점(더 뛰어나거나 변화가 없다)에서 4점(수행능력이 매우 떨어진다)까지로 응답하도록 하여 점수가 높을수록 인지기능장애 정도가 높음을 의미한다.
확인적 요인분석 결과 요인 부하량이 .69~.89로 모든 문항이 인지장애에 수렴하여 도구의 적합성을 확인하였다. 도구의 신뢰도 Cronbach's α는 선행연구[23]에서 .98이었고, 본 연구에서는 .97이었다. ECog도구는 원저자와 번안한 저자로부터 사용 허락을 받은 후 사용하였다.
6) 유방암관련 삶의 질
유방암 관련 삶의 질은 FACIT (Functional Assessment of Chronic Illness Therapy)에서 개발한 한국어판 FACT-B (Functional Assessment of Cancer Therapy-Breast Cancer version 4)를 이용하여 측정하였다[24]. FACT-B는 5개 하위영역, 37문항의 5점 척도로 신체상태(7문항), 사회/가족상태(7문항), 정서상태(6문항), 기능상태(7문항), 유방암 특이 삶의 질(10문항)로 구성되었다. 각 문항에 대하여 0점(전혀 그렇지 않다)에서 4점(매우 그렇다)으로 응답하도록 하여 총점은 0~148점이며, 점수가 높을수록 삶의 질이 높음을 의미한다.
확인적 요인분석 결과 사회가족상태(1문항), 정서상태(1문항)과 유방암상태(3문항)에서 요인부하량이 .50 이하였으며, 사회가족상태의 표준화된 요인부하량이 .13으로 삶의 질 구성개념에 대한 집중(수렴)타당도가 낮았다. 도구의 신뢰도 Cronbach's α는 개발 당시 .90이었으며, 본 연구에서는 .91이었다. FACT-B는 FACIT로부터 도구사용 허락을 받았다.
4. 자료 수집 방법
자료는 2015년 3월부터 4월까지 항암화학요법을 받기위해 외래를 방문하거나 입원한 환자 중 선정기준에 부합한 대상자에게 연구의 목적을 설명하여 연구 참여에 서면동의한 경우 자가보고식 구조화된 설문지를 배부하여 수집하였다. 항암화학요법관련 빈혈은 임상기록을 연구자가 조회하여 입력하였다.
5. 윤리적 고려
본 연구의 내용과 방법에 대하여 서울시에 소재한 W병원의 임상연구심의위원회의 승인(IRB NO: K-K-1503-002-01)을 받았다. 연구의 목적과 설문지 진행과정을 설명하였고, 연구참여 서면 동의서에 무기명 처리 및 비밀보장, 원하는 경우 어떠한 불이익 없이 언제든지 철회할 수 있음을 포함하였다. 수집된 설문지는 이름이 아닌 번호로 통계분석 될 것임을 공지하였으며, 개인정보의 유출예방을 위해 수거 후 잠금장치가 있는 장에 보관하여 연구자 외에 노출되지 않도록 하였으며, 연구논문 종료 후에 분쇄폐기 할 것을 설명하였다.
6. 자료 분석
수집된 자료는 SPSS 21.0과 AMOS 21.0 프로그램을 이용하여 분석하였다. 대상자의 일반적인 특성과 질병관련 특성은 서술적 통계로 분석하였으며, 연구도구의 타당도는 확인적 요인분석으로 검정하였다. 표본의 정규성은 다변량 정규성 검증을 통하여 평균, 표준편차, 왜도, 첨도로 확인하였고, 측정 변수들 간의 상관관계는 Pearson's correlation coefficient 파악하였다. 최대 우도법을 이용하여 모형의 모수 치를 추정하였고 모형의 적합도를 평가하기 위해 절대적합지수는 χ2검정, χ2/df, SRMR, RMSEA와 중분적합지수는 CFI, NFI, TLI 및 간명적합지수는 AIC 등으로 추정하였다. 모형의 경로에 대한 유의한 검증은 회귀계수, 표준오차, CR (critical ratio), p값으로 확인하였고, 내생변수의 설명력은 다중상관자승(squared multiple correlation)으로 검증하였다. 연구모형의 직·간접효과와 총 효과의 유의성을 검증하기 위해 Bootstrapping을 이용하였다.
연구 결과
1. 대상자의 일반적 특성 및 질병관련 특성
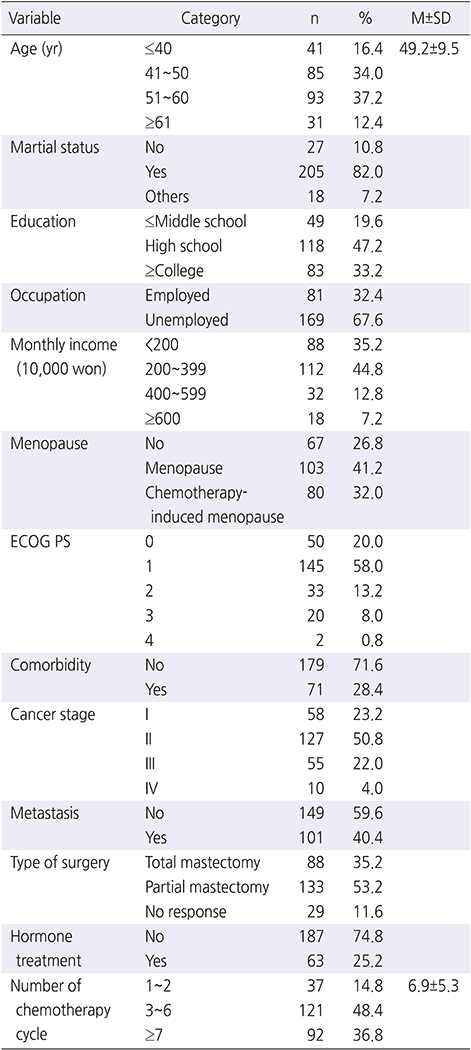
대상자의 평균 연령은 49.2세(±9.5)였으며, 50대가 93명(37.2%)으로 가장 많았고, 40대 85명(34.0%), 30대 이하 41명(16.4%), 60대 이상 31명(12.4%)순이었다. 기혼이 205명(82.0%)이었으며, 고졸이 118명(47.2%)으로 가장 많았고, 81명(32.4%)이 직업이 있었고, 월 소득은 200~399만원이 112명(44.8%), 200만원 미만이 88명(35.2%)순이었다.
자연폐경이 103명(41.2%)으로 가장 많았고, 항암제 투여 후 폐경이 80명(32.0%), 폐경 전이 67명(26.8%)순이었다. 활동정도는 거동이 자유로움이 145명(58.0%)으로 가장 많았고, 발병 전처럼 활동 50명(20.0%), 거동가능 33명(13.2%)순이었다. 동반 만성질환이 없는 경우가 179명(71.6%)이었으며, 병기는 2기 127명(50.8%), 1기 58명(23.2%), 3기 55명(22.0%), 4기 10명(4.0%)순으로 나타났다. 전이 없음이 149명(59.6%)이었고, 수술방법은 부분절제술이 133명(53.2%), 전절제술이 88명(35.2%)으로 많았고, 호르몬 치료를 받지 않은 경우가 187명(74.8%)이었다. 항암화학요법치료는 평균 6.9회(±5.3)를 받았으며, 3~6회를 받은 환자가 121명(48.4%)으로 가장 많았다(Table 1).
Table 1
Demographic and Disease Related Characteristics of the Participants (N=250)
2. 연구변수에 대한 서술적 통계 및 상관관계 분석
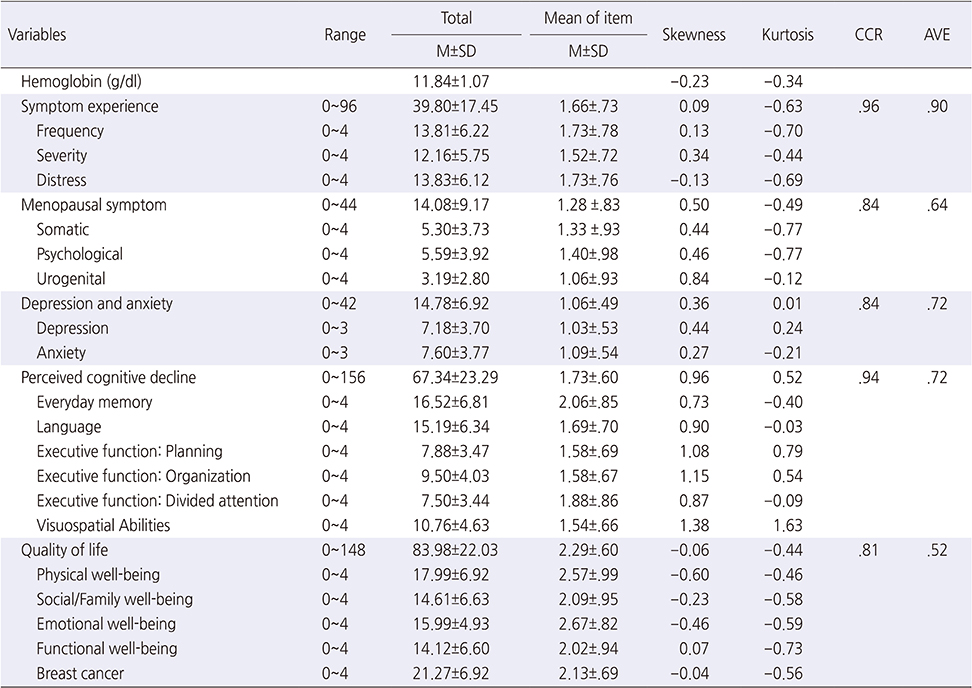
연구변수에 대한 서술적 통계 및 정규성 검정 결과는 다음과 같다(Table 2).
Table 2
Descriptive Statistics and Convergent Validity of Measured Variables (N=250)
대상자의 헤모글로빈 수치는 평균 11.84 g/dl였으며, 증상경험은 평균 39.80점, 갱년기 증상은 평균 14.09점, 우울과 불안의 평균은 14.78점, 인지장애는 평균 67.34점, 삶의 질의 평균은 83.98점이었다. 본 연구에 포함된 모든 측정변수의 왜도와 첨도의 절대값이 각각 1.96 범위에 분포하고 있어 구조방정식모형을 적용하는데 필요한 정규분포의 조건을 충족하였다. 연구변수간의 상관계수는 모두 .90 미만이었고 공차한계값이 .10 이상이고, VIF값이 모두 10미만으로 나타나 연구변수들 간의 다중공선성의 문제가 없는 것으로 확인되었다[16].
3. 구조모형의 검증
1) 연구변수의 타당성 검증
구성개념이 관측변수에 의해 얼마나 잘 측정되었는지는 집중(수렴)타당도(convergent validity)와 판별타당도(discriminant validity)로 확인하였다(Table 2). 집중타당도의 검증은 요인 부하량과 평균분산추출(Average Variance Extracted [AVE]) 및 구성개념신뢰도(Composite Construct Reliablity [CCR])를 이용하였다. 본 연구결과 삶의 질 하위영역인 사회가족상태의 요인 부하량이 .13으로 제거한 후[16] 측정모형을 재구성하였다. 그 외 빈혈, 증상경험, 갱년기 증상, 우울과 불안, 인지기능에서는 표준 요인부하량의 값이 모두 .5 이상을 충족하였고, 평균분산추출지수는(AVE) .5이상, 개념신뢰도(CR)는 .7이상의 기준을 충족하여 집중(수렴)타당도가 있는 것으로 나타났다. 판별타당성은 잠재변수의 AVE 값이 잠재변수간 상관계수의 제곱값보다 크면 판별타당성이 있는 것으로 간주하는데[16]. 본 연구에서 모두 충족하여 판별타당성이 입증되었다.
2) 가설적 모형의 검증 및 수정
가설적 모형의 적합도 검증 결과 χ2=439.32 (df=140, p<.001), χ2/df=3.14, CFI=.90, NFI=.91로 적합도 기준을 충족하였고, SRMR=.05, RMSEA=.09~.11, 및 AIC=539.32로 나타나 모형의 적합도 수치가 전체적으로 적합한 것으로 나타났다. 그러나 모형의 경로분석 결과 빈혈→인지기능으로 가는 경로가 유의하지 않았으므로 실증적 근거에 따라[16] 경로를 제거하는 모형의 수정이 필요할 것으로 판단되었다.
3) 수정모형의 검증 및 효과분석
가설모형의 경로계수에서 유의하지 않은 경로를 제거한 결과 간명적합지수인 AIC지수가 낮아졌으므로 수정 모형을 최종 모형으로 선택한 후 분석하였다. 수정 모형의 적합도는 χ2=423.18 (p<.001), χ2/df=3.38, CFI=.91 (≥.9), NFI=.91 (≥.9), SRMR=.05 (≤.1), RMSEA=.09~.11 (<.1), AIC=515.18로 권장수준을 충족하였다[16].
수정모형의 모수 치 추정결과, 표준화된 경로계수는 모두 유의한 것으로 나타났다(Figure 2B). 인지기능에 유의한 영향을 미치는 요인은 갱년기 증상(β=.38, p<.001), 우울과 불안(β=.25, p=.002), 증상경험(β=.19, p=.009)이었으며, 이들 변수가 인지기능을 설명하는 설명력은 47.7%였다. 우울과 불안에 유의한 영향을 미치는 요인은 증상경험(β=.39, p<.001)과 갱년기증상(β=.34, p<.001)이었으며, 이들 변수가 우울과 불안을 설명하는 설명력은 40.6%였다. 삶의 질에 유의한 영향을 미치는 요인은 우울과 불안(β=−.51, p<.001), 증상경험(β=−.27, p<.001), 갱년기증상(β=−22, p=.001) 및 인지기능(β=−.15, p=.020)이었으며, 이들 변수가 삶의 질을 설명하는 설명력은 91.3%였다.
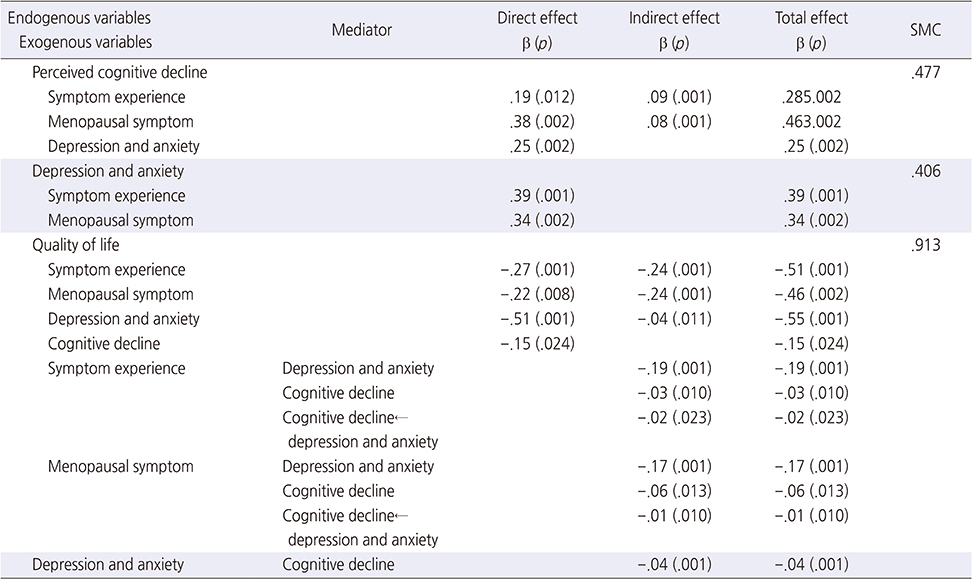
수정모형의 직접 효과, 간접 효과 및 총 효과를 분석한 결과는 다음과 같다(Table 3).
Table 3
Direct, Indirect, and Total Effect Analysis of Modified Model (N=250)
인지기능에 대한 각 변수의 효과를 살펴보면, 갱년기 증상(β=.38, p=.002)이 인지기능에 가장 큰 직접효과가 있었고, 우울과 불안(β=.25, p=.002), 증상경험(β=.19, p=.012)의 순으로 직접효과가 있었다. 증상경험(β=.09. p=.001)과 갱년기 증상(β=.08 p=001)은 우울과 불안을 통하여 인지기능에 영향을 미치는 간접효과가 있었다.
우울과 불안에 대하여 증상경험(β=.39, p=.001)이 가장 큰 직접효과가 있었고, 갱년기 증상(β=.34, p=.002)이 우울과 불안에 직접효과가 있었다.
삶의 질에 대한 각 변수의 효과는 우울과 불안(β=−.51, p=.001)이 가장 큰 직접효과가 있었고, 증상경험(β=−.27, p=.001), 갱년기 증상(β=−.22, p=.008) 및 인지기능(β=−.15, p=.024)의 순으로 직접효과가 있었다. 증상경험은 우울과 불안(β=−.19, p=.001), 인지기능(β=−.03, p=.010), 우울과 불안을 거쳐 인지기능(β=−.02, p=.023)을 통한 삶의 질에 영향을 미치는 간접효과가 있었다. 갱년기 증상은 우울과 불안(β=−.17, p=.001), 인지기능(β=−.06, p=.013), 우울과 불안을 거쳐 인지기능(β=−.01, p=.010)을 통한 삶의 질에 영향을 미치는 간접효과가 있었다.
우울과 불안의 경우 인지기능(β=−.04, p=.001)을 통해 삶의 질에 영향을 미치는 간접 효과가 있었다(β=−.04. p=.001).
논 의
본 연구는 항암화학요법 관련 인지기능 변화 모형[8]과 선행연구[9, 10]를 토대로 유방암 환자의 항암화학요법 관련 인지기능과 삶의 질에 관한 모형을 구축하고 항암화학요법관련 독성요인인 빈혈과 갱년기 증상(호르몬 관련 요인), 암 증상경험(증상요인) 및 우울과 불안(심리적 요인)간의 관계와 효과를 규명하였다.
본 연구의 수정모형은 실제자료와 부합되어 유방암 환자의 항암화학요법 관련 인지기능 변화를 설명하는데 적합한 모형으로 나타났다. 유방암 환자의 항암화학요법 관련 인지기능에 갱년기 증상, 우울과 불안 및 증상경험 순으로 영향력이 큰 요인으로 나타났으며, 이들 변수가 인지기능을 47.7% 설명하였다.
선행연구[8, 9]에서 암환자의 인지기능은 치료관련요인, 증상요인 및 심리요인에 의해 영향을 받는다고 하였는데, 본 연구의 결과에서 갱년기 증상(호르몬 요인)이 인지기능에 가장 큰 영향요인으로 나타나 에스트로겐의 감소로 인한 갱년기 증상이 인지기능저하에 중요한 요인이 된다는 것을 제시하였다. 에스트로겐은 자율신경기능을 조절하는 시상하부, 기억과 인지기능을 조절하는 측두 피질과 변연계 해마의 신경변성과 연관되어 인지기능을 손상시키는 것으로 보고되었다[25]. 이러한 결과는 성호르몬의 감소가 전반적 인지기능의 감퇴와 연관된다고 한 선행연구[26]와 유사하였다.
본 연구 대상자의 인지기능 정도는 4점 만점에 평균 1.73점이었으며, 문항평균 2점(가끔 떨어진다) 이상의 대상자가 24.8%로 나타났다. 본 연구에서 인지기능 저하를 느끼는 대상자가 비교적 적은 것은 폐경기 이후 발생률이 증가하는 서양과 달리[1] 본 연구 대상자의 평균연령이 49세로 비교적 젊고 항암화학요법을 받은 회수가 평균 6회로 현재 치료 중인 환자들이 많았기 때문인 것으로 생각된다. 이는 Von Ah 등[12]의 연구에서 고 연령이 인지기능장애에 영향을 주는 요인이며, 항암화학요법 관련 인지기능 저하 발생률은 항암화학요법 1개월 보다 종료 후가 더 높다고 한 연구[13, 27]와 맥락을 같이 하였다. 선행연구에서 항암화학요법 관련 인지장애가 경미하고 항암제 투여 후 1년 이내에 감소되는 것으로 보고하고 있으나, 대상자의 17~35%는 장기간 지속되거나 항암치료 후 후기에 발생하므로[28], 추후 종단적 연구를 통해 항암치료 종료 6개월 이후 시점에서 인지장애 정도를 파악할 필요가 있다. 또한 본 연구에서 인지장애를 흔히 유발하는 항암제를 투여받고 있는 환자를 대상으로 하였으나 항암제 종류별 누적용량과 부작용에 따른 인지장애를 파악할 필요가 있다.
본 연구 대상자는 기억력 저하를 가장 흔한 장애로 경험하고 있었고, 그 다음은 분배주의력의 저하를 경험하는 것으로 나타나 동일 도구로 측정한 항암화학요법을 받고 있는 유방암환자 대상의 연구[23, 29]와 폐경여성 대상의 인지기능장애의 하위 영역과 일치하고 있다[30]. 따라서 유방암 환자를 포함한 중년여성의 인지기능 중재는 기억력과 주의 집중력 증진에 중점을 두고 인지기능 향상을 위한 통합적 접근이 필요하다고 생각된다.
암환자의 인지기능 변화에 영향을 주는 두 번째 큰 요인은 우울과 불안으로 나타났다. 인지기능과 우울과의 관련성에 대하여 일부 선행연구에서는 대상자가 항암화학요법 관련 인지기능저하를 경험하면서 우울이 심화되었다는 결과변수로 제시하고 있으나[31], 본 연구결과는 우울이 암환자 인지기능의 영향요인이 된다는 항암화학요법 관련 인지기능 변화 모델[8]의 설명을 지지하고 있다. 또한 본 연구에서 우울과 불안은 증상경험, 갱년기 증상과 인지기능과의 관계에서 매개역할을 하는 것으로 나타났다. 즉 증상경험, 갱년기 증상은 우울과 불안에 직접적으로 영향을 주고 우울과 불안을 통해 간접적으로 인지기능에 영향을 주는 것으로 나타났다. 이러한 결과는 신체적 자각 증상이 높을수록 우울과 불안이 높고[32] 이로 인하여 신체적 기능과 인지기능이 저하된다고 한 연구[33]결과와 유사하였다. 본 연구를 통해 암환자의 인지기능 중재에 피로, 통증 등과 같은 증상경험이나 갱년기 증상을 사정하고 동시에 우울과 불안을 관리하는 것이 필요함을 확인할 수 있었다.
본 연구 대상자의 우울 정도는 경한 우울 24.0%, 중증도 이상의 우울 17.2%로 전체의 41.2%에 해당하는 대상자들이 우울 증상을 겪고 있는 것으로 나타났다. 또한 경한 불안 29.2%, 약물치료가 필요한 중등도 이상의 불안 21.6%로 전체의 50.8%에 해당하는 대상자들이 불안 증상을 경험하였다. 이러한 결과는 동일 측정도구를 사용하여 측정한 국내 항암화학요법 유방암 환자보다 우울과 불안 정도가 더 큰 것으로 나타나[34] 암환자의 우울과 불안에 대한 선별검사와 관리가 필요하다는 것을 제시하고 있다.
인지기능 변화에 영향을 주는 세 번째 큰 요인은 암 증상경험으로 나타났다. 항암화학요법의 부작용으로 동반되는 증상경험은 인지기능 감소에 실질적인 영향을 주었지만, 갱년기 증상에 비해서는 효과크기가 작았다. 이는 본 연구 대상자의 증상경험 점수는 4점 만점에 평균 1.66점으로 비교적 경미한 것과 관련된다고 생각된다. 이는 Vardy와 Tannock [9]의 항암화학요법 관련 인지기능의 개념 틀에서 질병/치료 관련 요인이 인지기능 감소를 촉진하는 요인임을 제시한 것과 유사하였다. 본 연구에서 증상경험은 피로, 오심, 통증, 식욕저하, 배변양상의 변화, 외모의 변화, 수면장애, 집중력 장애 등 8개에 대하여 조사하였는데, 추후 어떠한 증상경험이 인지기능에 영향을 미치는 지 확인하는 연구가 필요하다고 생각한다. 또한 유방암 환자의 인지기능을 증진하기 위한 중재 시 피로, 통증, 소화기 증상 등의 증상경험을 고려하는 전략이 필요한 것으로 보인다.
본 연구에서 삶의 질에 영향을 미치는 요인은 우울과 불안, 증상경험, 갱년기 증상 및 인지기능 순 이었으며, 이들의 삶의 질에 대한 설명력은 91.3%로 나타났다. 이중 인지기능 저하는 항암화학요법을 받는 유방암 환자의 삶의 질에 영향을 주었으나 우울과 불안보다는 효과크기가 낮았다. 이는 우울과 불안이 인지기능 저하에 직접적인 영향을 주고, 인지기능 저하를 통해 간접적으로도 삶의 질에 영향을 미쳐 설명력이 큰 변수로 나타난 것으로 보인다. 본 연구에서 인지기능저하는 심리적 디스트레스(우울과 불안)와의 상대적 크기에서 삶의 질을 설명하는 설명력이 낮았으나, 유방암환자 대상의 선행연구에서 삶의 질을 43% 설명하는 것으로 나타나[29], 암환자의 삶의 질에 중요하게 고려할 필요가 있다. 우울과 불안은 선행연구에서도[35] 유방암 환자의 삶의 질에 영향을 미치는 요인으로 65.6%의 설명력을 나타내고 있어 본 연구결과와 유사하였다. 이러한 암환자의 우울과 불안은 암 진단과 치료와 관련하여 증가되고 이것이 인지기능 저하에 영향을 주며 결과적으로 삶의 질과 관련이 되고 있음[8]을 알 수 있었다.
또한 본 연구에서 우울과 불안은 증상경험, 갱년기 증상과 삶의 질 간에 매개효과를 가지고 있는 것으로 나타났다. 따라서 유방암 환자의 항암화학요법 관련 삶의 질 향상을 위한 중재 시 우울과 불안을 고려한 전략이 필요하며, 환자의 인지기능저하와 증상경험 및 갱년기 증상을 통합적으로 관리하여 증상을 경감시킴으로써 우울과 불안을 완화시킬 수 있고 결과적으로 항암화학요법을 받는 유방암 환자의 삶의 질 향상을 도모할 수 있을 것이다. 본 연구에서 삶의 질은 FACT-B의 한국어판으로 측정하였는데, 이 도구는 유방암환자 삶의 질에서 사회적 관계 및 지지를 중요하게 볼 때 유용하게 활용될 수 있는 도구이다[36]. 본 연구에서 삶의 질 도구의 확인적 요인분석을 실시한 결과 하위영역 간 판별타당도는 있는 것으로 나타났으나 5개 문항(사회가족상태 1문항, 정서상태 1문항, 유방암상태 3문항)에서 요인부하량이 .5 이하로 수렴 타당도가 낮고, 도구의 적합도는 부분적으로 낮은 것으로 나타났다. 특히 사회가족상태의 표준화된 요인부하량이 .13으로 삶의 질 구성개념에 대한 집중(수렴)타당도가 낮은 것으로 나타나 사회가족상태를 제거한 후 측정모형을 재구성한 결과 적합도는 수용 가능한 것으로 나타났다.
본 연구는 유방암 환자의 항암화학요법 관련 인지기능 연구가 거의 이루어지지 않은 국내 현실에서 항암화학요법을 받는 유방암 환자의 인지기능변화 정도를 파악하고 관련된 요인을 규명하여 이를 환자들을 위한 지지 및 교육 프로그램 개발과 적용을 위한 이론적 근거로 활용될 수 있다는데 의의가 있다 하겠다. 본 연구에서는 인지기능과 갱년기 증상(호르몬 요인), 치료요인(증상경험), 심리적 요인(우울과 불안)과의 관련성에 초점을 두고 구조모형분석이 이루어졌으므로 추후연구에서는 항암 횟수, 항암제의 누적용량과 나이 등의 변수가 인지기능의 조절요인으로 작용하는지 함께 고려하여 검증할 필요가 있다. 본 연구의 제한점은 대상자의 인지기능을 주관적으로 조사하였다는 것이다. 따라서 본 연구의 주관적 인지기능의 결과가 객관적 인지기능에도 동일하게 적용되는지 검증할 필요가 있다.
결 론
본 연구에서 검증한 모형은 유방암 환자의 항암화학요법 관련 인지기능 변화를 설명하는데 적합한 것으로 나타났다.
유방암 환자의 인지기능에 갱년기 증상이 가장 큰 영향을 미치는 요인이었으며, 우울과 불안 및 암 증상경험 순으로 인지기능에 직접적인 영향을 주었고 이들 관계에서 우울과 불안은 부분매개 하는 것으로 나타났다. 암환자의 삶의 질에는 우울과 불안이 가장 큰 직접적인 영향을 주었고, 암 증상경험, 갱년기 증상 및 인지기능 순으로 직접적인 영향을 주었으며 이들 관계에서 인지기능이 부분매개 하는 것으로 나타났다. 이러한 결과는 유방암 환자의 항암화학요법 관련 인지기능 저하를 관리할 때 갱년기 증상을 사정하고 암 증상관리와 더불어 우울과 불안에 대한 중재가 필요하다는 것을 의미한다. 또한 인지기능을 향상시키는 중재를 통해 암환자의 삶의 질 향상을 기대할 수 있을 것이다.
이 논문은 제 1 저자 이정란의 박사학위논문 축약본임.
This article is a condensed form of the first author Lee Jung Ran's doctoral dissertation from Sahmyook University.
CONFLICTS OF INTEREST:The authors declared no conflict of interest.
References
-
Korea Breast Cancer Society. 2015 Breast cancer facts & figures [Internet]. Seoul: Korea Breast Cancer Society; c2015 [cited 2018 Jul 5].Available from: http://www.kbcs.or.kr/journal/file/2015_
Breast_ Cancer_ Facts_ and_ Figures_ updated.pdf.
-
-
Nelson CJ, Nandy N, Roth AJ. Chemotherapy and cognitive deficits: Mechanisms, findings, and potential interventions. Palliative & Supportive Care 2007;5(3):273–280. [doi: 10.1017/S1478951507000442]
-
-
Weiss B. Evaluation of multiple neurotoxic outcomes in cancer chemotherapy. In: Raffa RB, Tallarida RJ, editors. Chemo Fog. Advances in Experimental Medicine and Biology, vol 678. New York: Springer; 2010. pp. 96-112.
-
-
Woo JP. In: Understanding and concepts of structural equation model. Seoul: Hannarae Publishing Co.; 2012. pp. 275-377.
-
-
Chae MJ. In: A structural model for sexual function of patients with breast cancer [dissertation]. Gwangju: Chonnam National University; 2012. pp. 1-133.
-
-
Oh SM, Min KJ, Park DB. A study on the standardization of the hospital anxiety and depression scale for Koreans: A comparison of normal, depressed and anxious groups. Journal of Korean Neuropsychiatric Association 1999;38(2):289–296.
-
-
Chung BY, Cho EJ. Correlates influencing cognitive impairment in breast cancer patients receiving chemotherapy. Asian Oncology Nursing 2012;12(3):221–229. [doi: 10.5388/aon.2012.12.3.221]
-
-
Oppermann K, Fuchs SC, Donato G, Bastos CA, Spritzer PM. Physical, psychological, and menopause-related symptoms and minor psychiatric disorders in a community-based sample of Brazilian premenopausal, perimenopausal, and postmenopausal women. Menopause 2012;19(3):355–360. [doi: 10.1097/gme.0b013e31822ba026]
-
-
Lee JR, Oh PJ. Cognitive decline and quality of life among patients with breast cancer undergoing chemotherapy: The mediating effect of health promotion behavior. Korean Journal of Adult Nursing 2016;28(2):202–212. [doi: 10.7475/kjan.2016.28.2.202]
-
-
Kim JH, Oh PJ. Menopause symptoms and perceived cognitive decline in menopausal women: The mediating effect of health promotion behavior. Korean Journal of Adult Nursing 2017;29(2):200–210. [doi: 10.7475/kjan.2017.29.2.200]
-
-
Kim H, Kim S, Lee H, Oh SE. Factors affecting symptom experiences of breast cancer patients: Based on the theory of unpleasant symptoms. Asian Oncology Nursing 2014;14(1):7–14. [doi: 10.5388/aon.2014.14.1.7]
-
-
Kim KH, Chung BY, Kim GD, Byun HS, Choi EH, Cho EJ. Cognitive function in breast cancer patients receiving adjuvant chemotherapy. Asian Oncology Nursing 2012;12(1):1–11. [doi: 10.1016/j.genhosppsych.2007.10.008]
-
-
Byun HS, Kim GD. Impacts of fatigue, pain, anxiety, and depression on the quality of life in patients with breast cancer. Asian Oncology Nursing 2012;12(1):27–34. [doi: 10.5388/aon.2012.12.1.27]
-
-
Luckett T, King MT, Butow PN, Oguchi M, Rankin N, Price MA, et al. Choosing between the EORTC QLQ-C30 and FACT-G for measuring health-related quality of life in cancer clinical research: Issues, evidence and recommendations. Annals of Oncology 2011;22(10):2179–2190. [doi: 10.1093/annonc/mdq721]
-
 KSNS
KSNS
 E-SUBMISSION
E-SUBMISSION

 Cite
Cite