Articles
- Page Path
- HOME > J Korean Acad Nurs > Volume 52(2); 2022 > Article
- Research Paper Incidence and Risk Factors of Dyslipidemia after Menopause
- Ihn Sook Jeong, Hae Sun Yun, Myo Sung Kim, Youn Sun Hwang
-
Journal of Korean Academy of Nursing 2022;52(2):214-227.
DOI: https://doi.org/10.4040/jkan.21188
Published online: April 30, 2022
2Department of Nursing Science, Kyungsung University, Busan, Korea
3Department of Nursing, Dong-Eui University, Busan, Korea
4Department of Nursing Science, Dongseo University, Busan, Korea
Abstract
Purpose
This study was aimed at investigating the incidence and risk factors of dyslipidemia in menopausal women using a Korean community-based longitudinal study.
Methods
The subjects were 245 postmenopausal women without dyslipidemia who had participated in the Ansan-Ansung cohort study from 2001~2002 (baseline) to 2015~2016 (seventh follow-up visit). The dyslipidemia incidence was measured as incidence proportion (%) and incidence rate per 100 person-years. The predictors of developing dyslipidemia were analyzed with Cox’s proportional hazard model.
Results
The incidence of new dyslipidemia during the follow-up period was 78.4% (192 patients), and 11.9 per 100 person-years. Mean duration from menopause to developing dyslipidemia was 5.3 years in new dyslipidemia cases. The triglyceride/high density lipoprotein (TG/HDL-C) ratio at baseline (hazard ratio = 2.20; 95% confidence interval = 1.39~3.48) was independently associated with developing dyslipidemia.
Conclusion
Dyslipidemia occurs frequently in postmenopausal women, principally within five years after menopause. Therefore, steps must be taken to prevent dyslipidemia immediately after menopause, particularly in women with a high TG/HDL-C ratio at the start of menopause.
Published online Apr 30, 2022.
https://doi.org/10.4040/jkan.21188
Abstract
Purpose
This study was aimed at investigating the incidence and risk factors of dyslipidemia in menopausal women using a Korean community-based longitudinal study.
Methods
The subjects were 245 postmenopausal women without dyslipidemia who had participated in the Ansan-Ansung cohort study from 2001~2002 (baseline) to 2015~2016 (seventh follow-up visit). The dyslipidemia incidence was measured as incidence proportion (%) and incidence rate per 100 person-years. The predictors of developing dyslipidemia were analyzed with Cox’s proportional hazard model.
Results
The incidence of new dyslipidemia during the follow-up period was 78.4% (192 patients), and 11.9 per 100 person-years. Mean duration from menopause to developing dyslipidemia was 5.3 years in new dyslipidemia cases. The triglyceride/high density lipoprotein (TG/HDL-C) ratio at baseline (hazard ratio = 2.20; 95% confidence interval = 1.39~3.48) was independently associated with developing dyslipidemia.
Conclusion
Dyslipidemia occurs frequently in postmenopausal women, principally within five years after menopause. Therefore, steps must be taken to prevent dyslipidemia immediately after menopause, particularly in women with a high TG/HDL-C ratio at the start of menopause.
서론
1. 연구의 필요성
이상지질혈증은 총 콜레스테롤(total cholesterol [TC]), 중성지방(triglyceride [TG]), 저밀도 지단백 콜레스테롤(low density lipoprotein-cholesterol [LDL-C])의 비정상적 증가 또는 고밀도 지단백 콜레스테롤(high density lipoprotein-cholesterol [HDL-C])의 비정상적 감소를 특징으로 하는 지질과 지단백 이상으로 정의되며[1], 국내 사망원인 2위를 차지하는 심뇌혈관질환의 주요한 위험요인[2]으로 알려져 있다. 이상지질혈증은 진단 당시 사용한 혈중 지질의 종류에 따라 유병률이 변화될 수 있으나 국내외에서 보고된 연구에 따르면 높은 유병률을 보이는 비교적 흔한 건강문제이다. 미국 국민건강영양조사에 참여한 45~74세 성인 중 56.8%에서 이상지질혈증을, 45.8%에서 고콜레스테롤혈증을 보였고[3], 유럽연합 12개 국가의 50세 이상 성인 중 30%에서 TG의 증가 또는 HDL-C 감소를[4], 중국 북동부 7개 지역에 거주하는 40세 이상 성인의 35.8%에서 이상지질혈증을 보였다[5]. 한국의 경우 2019 국민건강영양조사에 따르면 30세 이상 성인의 고콜레스테롤혈증(콜레스테롤이 240 mg/dL 이상이거나 콜레스테롤 강하제 복용) 유병률은 25.8%이며 2009년 11.8%에 비해 10년간 약 2.2배의 급격한 증가를 보이고 있다[6].
이상지질혈증은 남녀 모두 연령의 증가와 함께 증가하지만, 성별에 따라 증가 양상은 다르게 나타나고 있다. 국내 2019 국민건강영양조사에 따르면 남성의 이상지질혈증 유병률은 40~49세 20.4%, 50~59세 26.0%, 60~69세 32.2%로 50대 이후 완만한 증가를 보이는 반면, 여성의 경우 4 0~49세 12.3%, 50~59세 36.4%, 60~69세 52.5%로 50대 이후 급격한 증가를 보였다[6]. 건강보험 자료로 구축된 코호트(National Health Insurance Service-National Sample Cohort) 데이터베이스 분석에서도, 남성은 연령에 따른 큰 변화가 없는 반면, 여성에서는 45~49세에 12.42%에서 50~54세 21.19%, 55~59세 25.55%로 증가하였다[7]. 여성의 연령에 따른 이상지질혈증의 큰 변화에 대해서는 폐경과 관련하여 설명되고 있다. 폐경으로 인한 호르몬 변화는 체지방의 분포에 영향을 주어 복부비만이 증가하며, 이는 인슐린 저항성과 이상지질혈증의 위험을 증가시키는 것으로 알려져 있다[8, 9]. 폐경과 대사증후군간의 관계에 대한 일 메타분석 연구에서 폐경 여성은 폐경전 여성에 비해 복부둘레, TG와 LDL-C 모두 증가하였다[10]. 국내 일개 병원에서 건강검진을 위해 내원한 중년 여성을 폐경 여부와 단계에 따라 구분하였을 때 폐경 여성에서 이상지질혈증의 유병률은 76.3%이며, 폐경전 여성에 비해 TC는 1.5배, LDL-C는 1.25배, non-HDL-C는 1.72배, 그리고 이상지질혈증은 1.28배 더 높은 유병률을 보였다[11]. 폐경이행기에는 에스트로겐 감소와 관련하여 약 80%의 여성이 홍조나 야간발한 등의 혈관운동증상(vasomotor symptoms)을 경험하는데, 혈관운동증상을 경험한 여성은 그렇지 않은 여성에 비해 TC과 LDL 콜레스테롤 등이 유의하게 증가하고, 코티솔 생성이 증가하여 인슐린 저항성이나 지질대사이상에도 영향을 주는 것으로 나타났다[12, 13].
이처럼 다양한 연구를 통해 폐경과 이상지질혈증간의 관계가 알려지고 있으나, 폐경 연령이나 폐경 후 이상지질혈증 발생시기(timing)에 대한 연구는 매우 제한적이다. 미국 간호사를 대상으로 한 전향적 코호트 연구에서 40세 이전에 폐경한 여성은 50~55세에 폐경한 여성에 비해 심혈관 질환의 위험이 32% 증가한다는 보고[14]를 감안할 때 폐경 연령이 이상지질혈증의 발생에 영향을 줄 수 있을 것으로 생각된다. 폐경 후 경과기간과 관련하여 국내 의료기관에 건강검진 목적으로 내원한 여성을 대상으로 한 연구에서 폐경전 여성에 비해 폐경 후 10~14년이 경과한 여성에서 2.4배 TG가 증가하였으며, HDL-C의 감소는 폐경 후 경과시간과 관련이 없음이 보고된 바 있다[15]. 그러나, 이 연구는 단면조사 연구로 동일한 대상자의 추적조사를 통해 이상지질혈증의 발생시기를 파악하지 못했다는 제한점이 있으며, 종단적 추적조사를 통해 폐경 후 시간적 경과에 따른 이상지질혈증의 발생시기를 파악하는 연구가 필요하다.
2. 연구 목적
본 연구는 대규모 지역사회 기반 코호트에 참여한 폐경 여성을 대상으로 장기간 추적조사를 통해 폐경 후 시간적 경과에 따른 이상지질혈증 발생과 위험요인을 파악함으로써 폐경 여성의 이상지질혈증 관리를 위한 근거를 제공하고자 한다. 구체적인 연구 목적으로 1) 기반조사 당시 연구대상자의 특성을 파악하며, 2) 폐경 연령에 따라 이상지질혈증 발생수준과 시기를 파악하고, 3) 폐경 후 시간적 경과에 따른 이상지질혈증 발생 위험요인을 파악하는 것이다.
연구 방법
1. 연구 설계
본 연구는 대규모 지역사회 기반 코호트인 한국유전체역학조사(Korean Genome and Epidemiology Study [KoGES]) 자료를 이용하여 폐경 여성을 대상으로 폐경 이후 시간적 경과에 따른 이상지질혈증 발생양상과 관련요인을 규명하기 위한 전향적 코호트를 활용한 2차 자료분석 연구이다.
2. 연구 대상
본 연구의 일차자료는 KoGES 중 중소도시와 농촌 지역을 대표하는 지역사회 기반 코호트(안산, 안성) 자료이며, 이 코호트는 2001~2002년 경기도 중소도시인 안산지역과 농촌인 안성지역에 거주하는 40~69세 성인 10,030명(안산 코호트 5,012명, 안성 코호트 5,018명) 등을 대상으로 한국인에게 흔한 만성질환의 위험요인을 규명하여 만성질환으로 인한 부담을 경감하고 삶의 질 향상을 도모하기 위한 과학적 근거를 마련하기 위해 구축되었다[16]. 2001~2002년 기반조사를 시작하여 매 2년마다 반복 추적조사를 수행하고 있으며, 사회인구학적 특성, 생활습관, 질환력, 여성력 등의 설문자료와 함께 검진을 통해 신체 계측과 임상검사(혈액, 소변)자료를 수집하고 있다. 본 연구에서는 기반조사부터 7차 추적조사(2015~2016년)까지 자료를 통합하여 정리한 반복 추적조사 통합자료에 포함된 변수를 활용하였다. KoGES 반복 추적조사 통합자료는 지역사회 기반 코호트의 기반조사 자료부터 특정 차수의 추적조사 자료가 독립적인 데이터 셋으로, 자료 활용 시 개별로 존재하는 자료를 통합해야 하는 번거로움을 덜기 위해 생성한 자료원이다.
본 연구 대상자는 기반조사 당시 폐경이며 이상지질혈증이 없는 여성 중, 이상지질혈증 발생 여부를 확인할 수 있도록 적어도 1회 이상 추적조사가 완료된 자로 하였으며, 다음의 선정기준을 모두 만족하는 자로 하였다; 1) 여성, 2) 기반조사 당시 폐경(폐경 여부, 폐경연령), 이상지질혈증, 그리고, 본 연구에 포함된 설명변수에 대한 자료가 있는 자, 3) 조사시점을 기준으로 2년 이내 폐경이 된 자, 4) 기반조사에서 이상지질혈증이 없는 자, 5) 적어도 1회 이상 추적조사가 완료되어 결과변수(이상지질혈증) 발생 정보가 있는 자, 이 때, 폐경은 여성력 조사에서 “최근 3개 월간 생리가 있었습니까”라는 질문에 대해 “아니오, 지난 12개월 이상 생리가 없었다”로 응답한 경우로 정의하였다. 해당 문항은 2차 추적조사부터 조사가 시작되었으며, 2차 추적조사에서 조사된 폐경연령을 기준으로 기반조사와 1차 추적조사 당시 폐경 여부를 결정하였다. 폐경 후 경과기간은 조사 시점에서의 연령에서 폐경연령의 차이로 계산하였다. 폐경 후 경과기간이 긴 경우 폐경 당시 대상자의 특성을 반영하기 어려울 수 있어 본 연구에서는 폐경 후 2년 이내의 여성을 포함하는 것으로 하였으며, 이는 선행문헌[17]의 분류기준과 지역사회 기반 코호트의 조사주기가 2년인 점을 고려하였다.
표본 수 산정은 ClinCalc 프로그램(ClinCalc LLC, USA) [18]을 이용하였으며, 연구 집단은 “독립표본 두 집단”, 일차결과변수는 “이범주”를 각각 선택하고, 기대되는 발생률은 체질량지수와 이상지질혈증과의 관계를 분석한 선행문헌[19]을 참고하였다. 이 연구는 일본 중년여성을 대상으로 한 것으로 체질량지수 25 kg/m2 미만(n = 738)에서 이상지질혈증 발생 위험비(hazard ratio [HR])는 1,000인년당 87.4, 25 kg/m2 이상(n = 188)인 여성에서는 275.1이었다[19]. 두 군간의 비는 1:4, 유의수준(α)는 .05, 검정력(1 - β)은 .85로 하였을 때 필요한 최소 표본 수는 240명(집단 1 = 48, 집단 2 = 192)이었다.
지역사회 기반 코호트에 참여한 10,030명 중 여성은 5,272명이며, 폐경, 이상지질혈증과 설명변수에 대한 자료가 없는 자(1,361명), 폐경이 아니거나 폐경 후 2년이 경과한 자(3,493명), 기반조사에서 이상지질혈증이 있는 자(163명), 추적조사가 없어 이상지질혈증 발생 여부가 확인되지 않는 자(10명) 등 5,027명을 제외하고, 선정기준에 부합하여 분석대상자로 포함된 자는 245명(Supplementary Figure 1)으로, 분석에 필요한 최소 표본 수는 충족되었다.
3. 연구 변수와 정의
1) 결과변수: 이상지질혈증
본 연구는 선행문헌[20]의 이상지질혈증에 대한 정의를 참고하여 다음의 5가지 기준 중 하나라도 만족하는 경우로 “이상지질혈증 있음”으로 정의하였다; 1) 의사로부터 이상지질혈증으로 진단받았다고 자가보고한 경우, 2) 이상지질혈증 치료제를 복용하고 있는 경우, 3) 고콜레스테롤혈증(TC ≥ 240 mg/dL); 4) 고중성지방혈증(TG ≥ 200 mg/dL); 5) 저HDL-C혈증(HDL-C < 40 mg/dL). 한편, 선행연구에서 이상지질혈증을 정의하는 데 포함된 고LDL-C혈증(LDL-C ≥ 160 mg/dL)의 경우 본 연구에서는 제외하였는데, KoGES 자료 수집당시 LDL-C를 직접 측정하지 않아 Friedewald식(TC - HDL-C - TG/5) [21]을 이용하여 계산한 결과 일부 대상자에서 음의 값을 보였기 때문이다.
2) 설명변수
혈중 지질의 분포는 연령, 교육수준, 소득 등의 인구사회학적 특성에 따라 차이를 보였으며[22, 23], 심혈관질환의 위험요인으로 알려진 흡연, 비만, 음주, 고혈압과 제2형 당뇨병은 여러 연구에서 일관되게 이상지질혈증의 위험을 높이는 것으로 나타났다[4, 5, 19]. 인슐린 저항성(insulin resistance)은 혈중 TG와 LDL-C를 증가시키는 반면 HDL-C를 떨어뜨리며[24], 심혈관계 질환 가족력도 이상지질혈증과 관련이 있는 것으로 보고되었다[7]. 이러한 선행문헌에서 이상지질혈증과의 관련성이 보고된 변수를 중심으로 연령, 교육수준, 결혼상태, 가구소득, 흡연, 음주, 비만, 영양섭취, 고혈압, 당뇨병, 인슐린 저항성, 가족력, 그리고 혈중 지질 등을 설명변수로 선정하였다. 각 변수는 설문조사 또는 생리적 검사로부터 얻어진 것이며, 원 자료를 그대로 이용하거나 연구목적에 맞게 변환하거나 범주화하여 사용하였다.
연령은 기반조사 당시 연령과 폐경 연령 등 2가지를 조사하였고, 폐경 연령에 따른 이상지질혈증 발생양상을 분석하기 위해 폐경 연령을 “40~49세”와 “50~59세”로 범주화하였다. 교육수준은 “중졸 이하”와 “고졸 이상”으로, 결혼상태는 “기혼”과 “기타”(미혼, 이혼, 별거 등)로, 가구소득은 2003년 가구소득에 가장 가까운 범주인 300만원[25]을 기준으로 “300만원 미만”과 “300만원 이상”으로 범주화하였다. 흡연과 음주는 현재 상태를 기준으로 현재흡연과 현재음주로 범주화하였다. 비만은 대한비만학회[26]의 기준에 따라 체질량지수(body mass index [BMI]) 25 kg/m2 이상으로 정의하였으며, 신체계측으로 얻어진 체중(kg)과 신장(m) 자료를 이용하여 “체중(kg) / 신장(m)2”의 공식으로 계산하였다. 영양섭취는 식품을 통해 섭취한 에너지(kcal), 단백질(g), 지질(g), 탄수화물(g), 식이섬유(g) 등의 1일 섭취량 자료를 사용하였다. 이 자료는 106개 항목으로 구성된 식품조사빈도 설문지를 이용하여 지난 1년간 평균 섭취빈도와 1회 섭취분량을 측정한 후 영양소별 1일 섭취량을 계산한 것으로[27], KoGES 대상자의 영양섭취량을 평가하는 데 적절한 것으로 확인되었다[28]. 고혈압은 1) 고혈압 약물을 복용, 2) 수축기혈압 ≥ 140 mmHg, 3) 이완기혈압 ≥ 90 mmHg [29, 30] 등 3가지 기준 중 하나라도 만족하는 경우 “고혈압 있음”으로 정의하였다. KoGES에서 수축기혈압과 이완기혈압은 좌우측을 구분하여 측정하였으며, 본 연구에서는 좌우측 중 높은 측정값을 이용하였다. 당뇨병은 1) 경구혈당강하제 복용 또는 인슐린 투여, 2) 공복혈당 ≥ 126 mg/dL, 3) 식후 2시간 혈당 ≥ 200 mg/dL, 4) HbA1c ≥ 6.5% 등 4가지 기준 중 하나 이상을 만족하는 경우 “당뇨병 있음”으로 정의하였다[31, 32]. 인슐린 저항성은 Matthews 등[33]이 제안한 Homeostasis model assessment-insulin resistance을 이용하였으며, “(공복혈당 × 공복인슐린) / 405”의 공식을 이용하여 산정하였다. 가족력은 고혈압, 당뇨병, 심장질환 등 3가지 질환에 대한 가족력을 포함하였으며, 대상자를 기준으로 부모 또는 형제자매 중 누구라도 해당질병을 진단받은 경험이 있는 경우 “가족력 있음”으로 범주화하였다. 혈중 지질은 혈액검사를 통해 측정된 TC, TG, HDL-C 외에, 이들로부터 계산된 non-HDL-C (TC-HDL-C)와 TG-HDL ratio (TG/HDL-C)를 포함하였으며, 원 측정자료와 함께 심뇌혈관질환 발생위험을 고려하여 범주화하여 사용하였다. TC는 “< 240 mg/dL”와 “200~239 mg/dL”, TG는 “< 150 mg/dL”와 “150~199 mg/dL”, HDL-C는 “40~59 mg/dL”와 “≥ 60 mg/dL”[20]로 범주화하고, non-HDL-C은 “< 141.5 mg/dL”와 “≥ 141.5 mg/dL”, TG-HDL ratio는 “< 2.79”와 “≥ 2.79”[34]로 범주화하였다.
4. 자료분석 방법
본 연구에서 수집된 자료는 SPSS Statistics for Windows version 25.0 (IBM Corp., Armonk, NY, USA)을 사용하여 분석하였으며, 통계적 검정은 유의수준 .05에서 양측 검정하였다.
1) 기반조사 당시 연구대상자의 특성은 범주형 자료의 경우 빈도와 백분율로, 연속형 자료의 경우 평균과 표준편차 또는 중앙값과 사분위수 범위를 산출하였다.
2) 이상지질혈증 발생수준은 발생분율(incidence proportion)과 100인년당(person-year [PY]) 발생률(incidence rate)을 계산하였다. 인년은 폐경부터 추적이 종료된 시점까지의 기간의 총합으로 계산되며, 이상지질혈증이 발생한 대상자는 폐경연령에서 이상지질혈증 발생 시 연령의 차이를, 비발생자는 폐경연령에서 마지막 추적이 완료된 시점에서의 연령의 차이로 하였다. 발생시기는 이상지질혈증이 발생한 대상자와 전체 대상자를 대상으로 폐경 후 이상지질혈증 발생까지의 경과시간의 평균과 표준편차 또는 중앙값과 범위를 구하고, 폐경 연령별 이상지질혈증 발생비율과 발생률을 산출하였다.
3) 폐경 후 시간적 경과에 따른 이상지질혈증 발생 위험요인을 분석하기 위해 먼저 Cox proportional hazard model을 적용한 생존분석으로 각 설명변수별 발생 위험비(HR)와 이의 95% 신뢰구간(confidence interval [CI])을 구하였다. 범주화한 혈중 지질 변수와 이상지질혈증 발생간의 관계에 대해서는 Kaplan-Meier 추정방법을 이용하여 생존곡선을 구하고, 로그순위 검정을 실시하였다. 다음으로, 혈중 지질을 제외한 변수(model 1)를 일차로, 그리고 혈중 지질(model 2)을 이차로 설명변수를 위계적으로 투여한 후 Cox proportional hazard model을 적용한 생존분석을 통해 다른 변수의 효과를 통제한 후 이상지질혈증 발생 위험요인을 확인하였다. 분석에 앞서 다중공선성을 확인하기 위해 설명변수 간 상관분석을 실시하였고, 영양섭취 변수 간에는 .51~.94의 중등도 이상의 상관성이 확인되어 에너지 섭취량 변수만을 사용하였으며, 혈중 지질 변수 간에는 TC와 TG (ρ = .94, p < .001), non-HDL-C와 TG/HDL-C (ρ = .92, p < .001)에서 높은 상관성을 보여(Supplementary Table 1), 변수 간 상관성이 낮은 혈중 지질 변수 중 TG, HDL-C, TG/HDL-C 등 3개의 변수를 투입하였다.
4) 이상지질혈증 발생 위험요인은 시간적 경과에 따라 변화될 수 있음을 감안하여 기반조사와 관찰 종료시점에서의 대상자 특성의 차이와 관찰 종료시점에서의 대상자 특성과 이상지질혈증 발생간의 관련성에 대한 추가분석을 실시하였다. 전자에 대한 분석은 Wilcoxon signed rank test 또는 McNemar test를, 후자에 대한 분석은 Mann-Whitney U test, χ2 test 또는 Fisher’s exact test를 이용하였다,
5. 윤리적 고려
본 연구계획서는 경성대학교 생명윤리위원회의 연구 승인(IRB No. 19-05-001)을 받았으며, 승인서를 질병관리청 KoGES 담당부서에 제출하고, 연구에 사용할 반복 추적조사자료는 익명화된 상태로 제공받았다.
연구 결과
1. 기반조사 당시 연구대상자의 특성
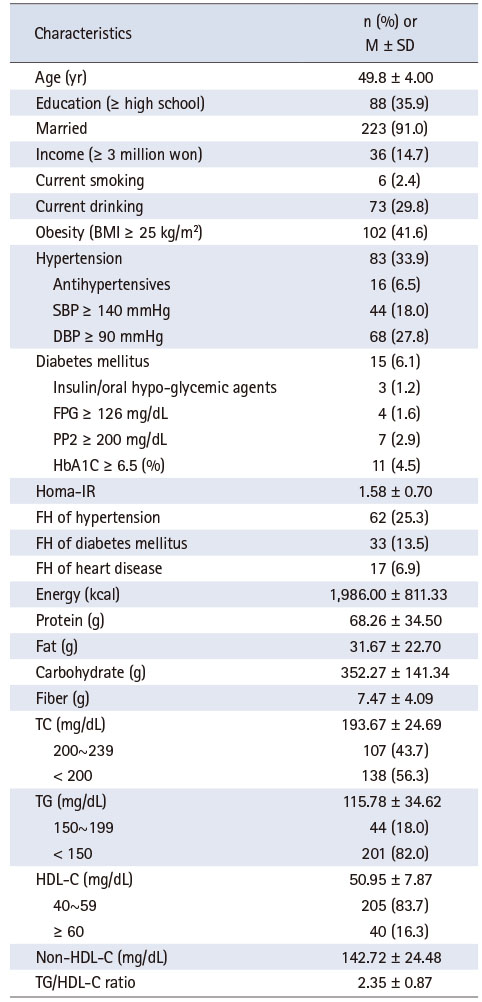
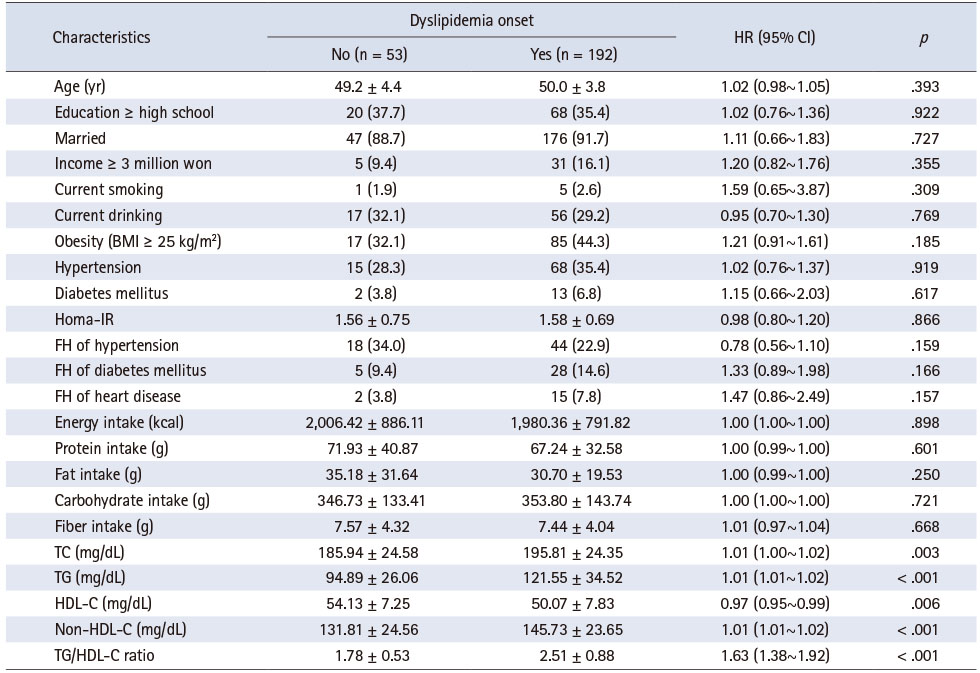
Table 1은 기반조사 시점에서 연구대상자의 특성을 분석한 결과이다. 대상자의 평균 연령은 49.8세, 고졸 이상이 35.9%이며, 현재 흡연과 음주를 하는 대상자는 각각 2.4%와 29.8%, 고혈압과 당뇨가 있는 경우가 각각 33.9%와 6.1%였다. 평균 TC는 193.67 mg/dL, HDL-C는 50.95 mg/dL이며, TG/HDL-C 비는 2.35이었다.
Table 1
Subjects’ Characteristics at Baseline (N = 245)
2. 이상지질혈증 발생수준과 시기
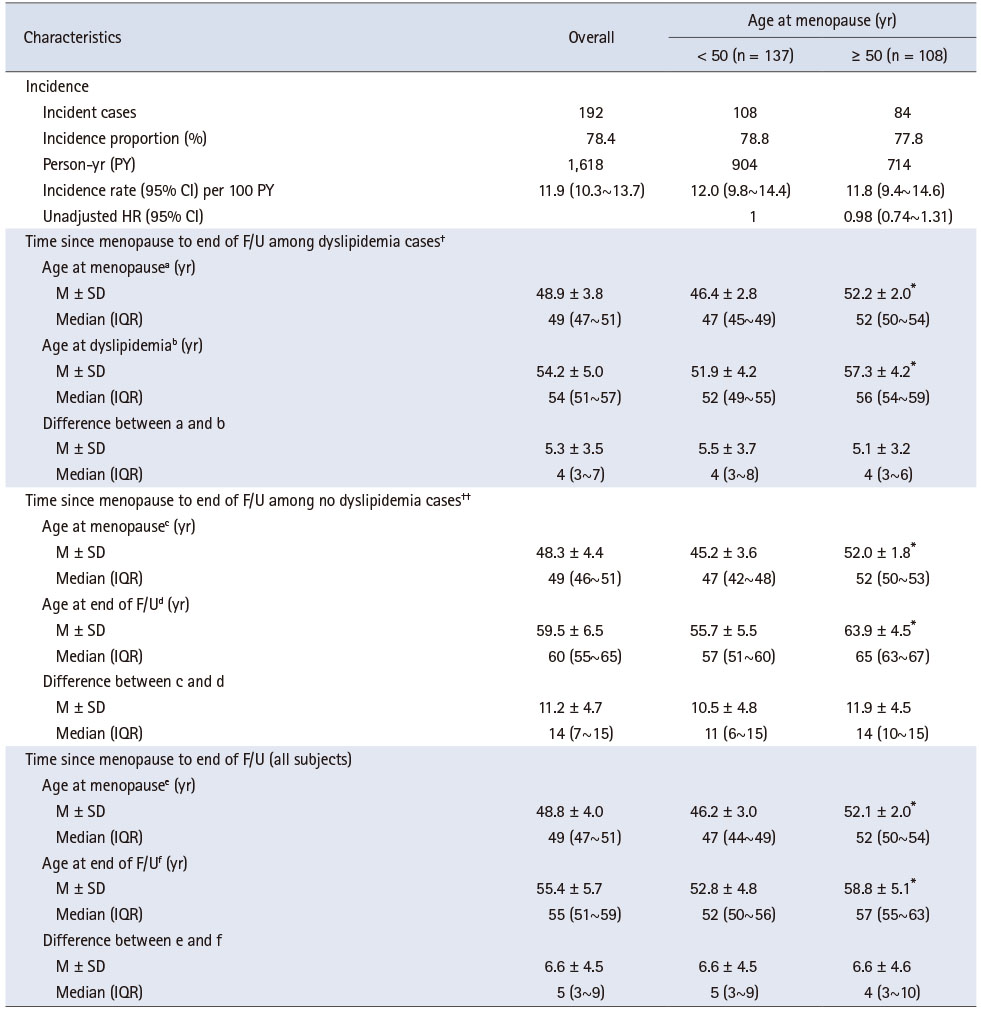
이상지질혈증 발생수준과 시기에 대한 분석결과는 Table 2와 Supplementary Figure 2에 제시하였다. 분석대상 245명 중 192명에서 이상지질혈증이 발생하여 발생분율은 78.4%이며, 100인 년당 발생률은 11.9건이었다. 이상지질혈증이 발생한 대상자의 발생 당시 연령은 평균 54.2세이며, 폐경 후 발생까지 경과한 기간은 평균 5.3년이었고, 이상지질혈증이 발생하지 않은 대상자의 경우 폐경 후 관찰기간은 평균 11.2년이었다.
Table 2
Incidence and Timing of Dyslipidemia (N = 245)
한편, 폐경 당시 연령을 50세 미만과 50세 이상으로 구분하였을 때 100인년당 발생률은 각각 12.0건과 11.8건으로 통계적으로 유의한 차이는 없었다(p = .899). 이상지질혈증이 발생한 대상자에서 폐경 후 발생까지 경과한 기간은 폐경 당시 연령이 50세 미만에서는 평균 5.5년, 50세 이상에서는 5.1년이며, 대상자의 50%에서 이상지질혈증이 발생하기까지 모두 4년이 소요되었고 폐경 연령에 따른 경과시간에는 유의한 차이가 없었다. 이상지질혈증이 발생하지 않은 대상자에서도 폐경 연령에 따른 경과시간에는 유의한 차이가 없었다.
3. 폐경 후 시간적 경과에 따른 이상지질혈증 발생 위험요인
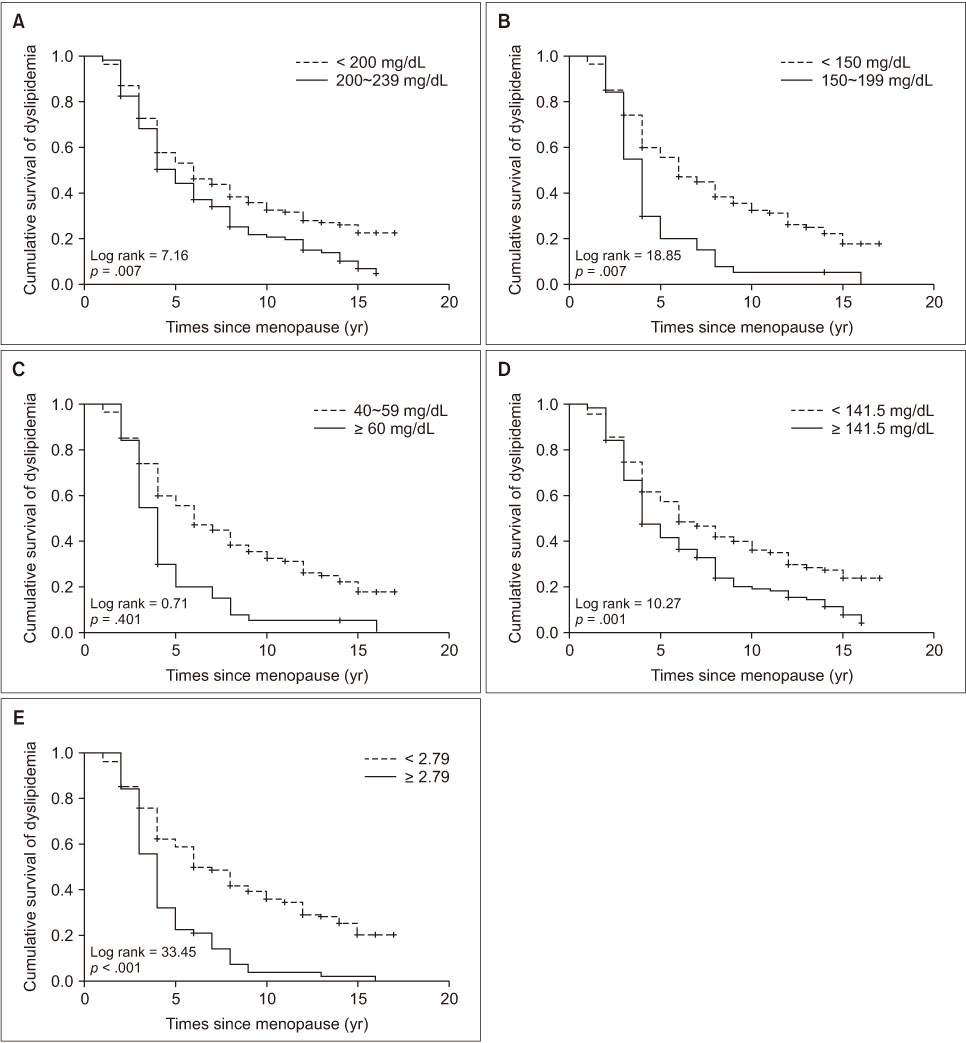
Cox proportional hazard model을 적용한 생존분석에서 시간적 경과에 따른 이상지질혈증 발생과 관련이 있는 변수는 혈중 지질이며, TC (p = .003), TG (p < .001), HDL-C (p = .006), non-HDL-C (p < .001), 그리고 TG/HDL-C 비(p < .001) 등에서 모두 유의한 관련성이 있었다(Table 3). 혈중 지질을 범주화한 후 Kaplan-Meier 분석을 실시한 결과, TC가 200~239 mg/dL (p = .007)인 경우, TG가 150~199 mg/dL (p = .007)인 경우, non-HLD-C가 141.5 mg/dL 이상(p = .001)인 경우, 그리고 TG/HDL-C ratio가 2.79 이상(p < .001)인 경우 그렇지 않은 경우에 비해 시간적 경과에 따른 이상지질혈증 발생 위험이 유의하게 증가하였다(Figure 1). 그리고, TG/HDL-C ratio가 2.79 이상인 경우 대상자의 50%에서 폐경 후 이상지질혈증 발생까지 경과기간은 4년(95% CI = 3.52~4.48), 2.79 미만인 경우에는 6년(95% CI = 4.69~7.31)이 소요되었다.
Figure 1
Survival curve of dyslipidemia onset according to lipid profiles at baseline survey. (A) Total cholesterol. (B) Triglyceride. (C) High density lipoprotein-cholesterol (HDL-C). (D) Non-high density lipoprotein-cholesterol. (E) Triglyceride/HDL-C ratio.
Table 3
Comparison of Subjects’ Characteristics at Baseline according to Dyslipidemia Onset (N = 245)
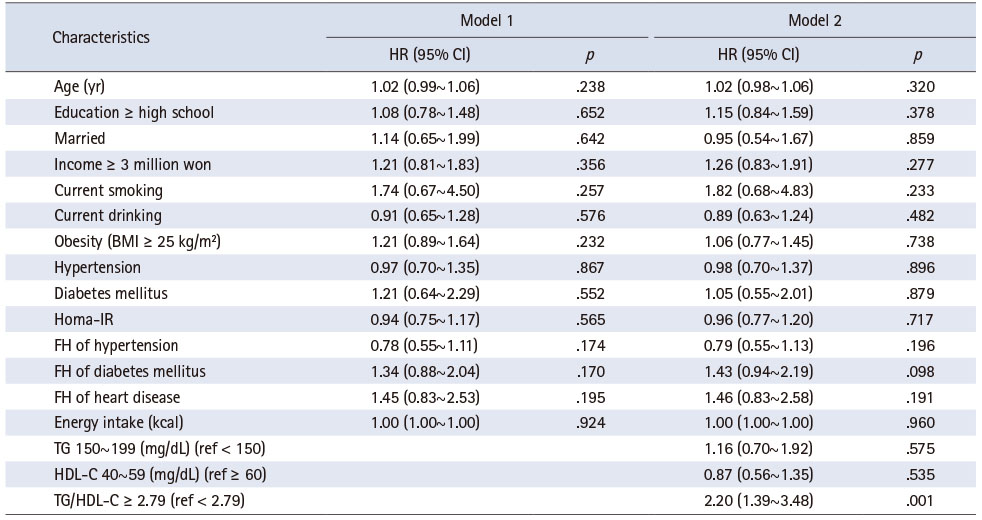
설명변수를 위계적으로 투여한 다중 분석에서 시간적 경과에 따라 이상지질혈증 발생과 관련이 있는 변수는 TG/HDL-C이며, 연구대상자의 기반조사 당시 특성을 통제하였을 때, TG/HDL-C이 2.79 이상인 경우 2.79 미만에 비해 이상지질혈증 발생 위험이 2.20배(p = .001) 증가하였다(Table 4).
Table 4
Risk Factors for Dyslipidemia Onset after Menopause
4. 추가분석
기반조사와 관찰 종료시점에서의 대상자 특성의 차이에 대한 추가분석 결과 연령, 가구소득, 당뇨병, 인슐린 저항성, 가족력(고혈압, 당뇨병, 심질환), 혈중 지질 중 TC와 non-HDL-C이 시간적 경과에 따라 유의하게 증가하였다. 그러나, 이상지질혈증 발생 위험요인으로 확인된 TG/HDL-C 비는 기반조사와 관찰 종료시점 당시 유의한 차이를 보이지 않았다(Supplementary Table 2).
관찰 종료시점에서의 대상자 특성과 이상지질혈증 발생간의 관련성에 대한 추가분석에서 혈중 지질 변수 외에 연령(p < .001)과 결혼상태(p < .001)가 새로이 확인되었으며, 이상지질혈증이 있는 대상자의 평균 연령과 기혼율이 더 높았다.
논의
본 연구는 KoGES 중 중소도시와 농촌 지역을 대표하는 지역사회 기반 코호트 자료를 활용하여 폐경 후 2년 이내의 이상지질혈증이 없는 40세 이상 여성 245명을 대상으로 폐경 이후 14년 간의 추적 동안 이상지질혈증 발생수준과 시기, 그리고 위험요인을 규명하고자 실시되었다. 연구결과, 192명(78.4%)에서 이상지질혈증이 발생하였고, 100인년당 발생률은 11.9건이었다. 즉, 관찰기간 동안 폐경 여성 100명당 약 78명에서 이상지질혈증이 발생하였으며, 연간 발생률은 여성 100명당 약 5.6명에 해당하였다.
이상지질혈증 유병률에 대한 연구[4, 22, 35]는 다수 보고되고 있는 반면 발생률에 대한 연구는 제한적이며, 특히 폐경 후 이상지질혈증 발생률을 보고한 연구는 찾아보기 힘들었다. 일본에서 18세 이상(평균 연령이 48.9세) 여성 927명을 대상으로 16년간(중앙값 1년) 추적하였을 때 이상지질혈증(HDL-C < 40 mg/dL, LDL-C ≥ 140 mg/dL, TG ≥ 150 mg/dL) 발생률은 100인년당 11.79건이었다[19]. 이란에서 Isfahan Cohort Study 자료를 이용하여 35세 이상 여성의 7년간 고콜레스테롤혈증(TC ≥ 200 mg/dL, anti-lipidemic agents)과 고중성지방혈증(TG ≥ 150 mg/dL, anti-lipidemic agents) 발생률은 각각 55.4%와 33.5%이며[36], 또 다른 연구에서 20세 이상 여성의 5년간 이상지질혈증(TC ≥ 200 mg/dL, TG ≥ 150 mg/dL, LDL ≥ 130 mg/dL, HDL < 50 mg/dL) 발생률은 64.8%였다[37]. 스위스에서 실시한 연구에서 5.6년간 추적조사한 결과 여성의 이상지질혈증(TG ≥ 150 mg/dL, HDL < 50 mg/dL, anti-lipidemic agents)의 발생률은 19.7%였다[38]. 캐나다에서 18세 이상 성인에서 9년간 이상지질혈증(TC ≥ 200 mg/dL, HDL < 40 mg/dL [남], HDL < 50 mg/dL [여]) 발생률은 25%이며, 성별에 따라, 연령에 따라 차이가 없는 것으로 나타났다[39]. 이들 연구에서는 여성들의 폐경 여부가 확인되지 않으며, 이상지질혈증에 대한 정의가 모두 달라 발생률을 본 연구결과와 직접 비교하기에는 제한점이 있다.
이상지질혈증 발생자의 발생 당시 평균 연령은 54.2세로, 폐경 후 약 5.3년이 경과한 후 이상지질혈증이 발생하는 것으로 나타났다. 이러한 결과는 국내 건강보험자료를 이용한 분석에서 폐경 연령대인 45~49세의 고콜레스테롤혈증이 12.4%이던 것이 5년이 경과한 50~54세에서 21.2%로 급증[7]하는 것을 지지하는 것이라고 할 수 있다. 국내 단면조사에서 폐경 후 10~14년이 경과한 여성에서 TG의 유의한 증가[15]를 보고하였으나, TG의 유의한 증가 전이라도 이상지질혈증의 진단기준을 충족할 수 있기 때문에 폐경 후 비교적 이른 기간에 이상지질혈증이 발생함을 알 수 있다.
국내 여성의 평균 폐경 연령이 49.9세라는 선행연구[40]에 따라 폐경 연령을 50세를 기준으로 분류하였을 때 이상지질혈증 발생수준과 발생시기에는 차이가 없었다. 일 메타분석연구에서 폐경 연령을 달리하여 심질환위험을 고찰하였는데, 45세 이전의 조기폐경자는 45세 이후 폐경자에 비해 심혈관질환과 치명적 심혈관질환 위험이 모두 증가하였고, 45~49세 폐경자와 50세 이후 폐경자에서는 경동맥 죽상경화증 위험 증가를 제외한 심혈관질환의 위험은 없는 반면, 55세 이후 폐경자는 50~54세 폐경자에 비해 심혈관질환 발생 위험이 감소하는 결과를 보였다[41]. 즉, 폐경 연령이 늦어질수록 심혈관질환에 대한 예방효과가 있음을 알 수 있다. 본 연구에서는 폐경 연령이 45세 미만과 55세 이상인 대상자는 34명과 16명에 불과하여 분석을 실시하지는 못하였으며, 표본 수를 확대한 추후 연구가 필요할 것으로 생각된다.
본 연구에서 폐경 후 이상지질혈증 발생은 기반조사 시점의 TG/HDL-C의 증가와 관련이 있는 것으로 확인되었다. 단변량 분석에서는 TG/HDL-C 외에도 모든 혈중 지질 지표가 이상지질혈증 발생과 관련이 있었으나, 지표간의 높은 상관성을 고려하여 TG, HDL-C, T G/HDL-C만이 다 중 분석에 포함되었고, TG/HDL-C만이 이상지질혈증 발생 위험을 증가시키는 것으로 나타났다. TG/HDL-C는 TG와 HDL-C로 구성된 복합지표로 TG나 HDL-C의 혈중 농도가 이상지질혈증 진단기준에 부합하지 않아도, 두 지표의 조합에 따라 절단점인 2.79 [34]를 초과하는 경우 이상지질혈증이 발생할 수 있음을 의미한다. 본 연구대상자는 기반조사 당시 이상지질혈증이 없는 자로, 개별 혈중 지질 지표보다, 이들로 계산되는 복합지표에도 관심이 필요하다. TG/HDL-C와 함께 TC/HDL-C도 HDL 하위분류 분포를 반영하는 주요 지표이지만 TG/HDL-C가 TC/HDL-C에 비해 HDL 하위분류 분포에 영향을 주는 더 강력한 요인[42]이므로 본 연구에서는 TG/HDL-C만을 사용하였다. HDL 입자(particle)는 대식세포로부터 콜레스테롤 유출을 촉진함으로써 죽상경화를 예방하는 효과를 보이며, 이러한 기능은 HDL-C보다 HDL 하위분류가 더 우수한 것으로 알려져 있다[43]. 추가분석에서 확인한 바에 따르면, TG/HDL-C은 기반조사와 관찰종료 시점에서 유의한 차이를 보이지 않아 비교적 안정적인 혈중 지표로 생각되며, 이상지질혈증 발생을 예측하는 데 효과적으로 활용할 수 있을 것으로 기대된다.
선행문헌에서 이상지질혈증 발생 관련요인으로 보고되었던 흡연, 음주, 비만, 고혈압과 제2형 당뇨병과 같은 심혈관질환 위험요인[4, 5, 11], 영양섭취[1, 44], 인슐린 저항성[24], 그리고, 심혈관계 질환 가족력[7]과는 관련이 없는 것으로 나타났다. 이러한 결과는 선행 연구가 다양한 연령대의 성인 남녀를 대상으로 하고 있는 반면에 본 연구는 최근 2년 이내 폐경한 비교적 동일한 특성을 가진 여성만을 대상으로 하고 있어 대상자 특성의 다양성이 줄어들기 때문이라고 볼 수 있다. 또 다른 가능한 원인은 표본크기가 충분한 통계적 검정력을 확보하기에는 부족하였기 때문이다. 예를 들어, 본 연구에서 비만(BMI ≥ 25 kg/m2)인 대상자의 이상지질혈증 발생률은 83.3%이고 비만이 아닌 경우 74.8%이었으며, 이를 ClinCalc 프로그램[18]을 이용하였을 때 80%의 통계적 검정력을 확보하기 위해 필요한 최소 표본크기는 각각 359명씩 총 718명이었다. 마찬가지로 당뇨병 유무에 따른 이상지질혈증 발생률은 각각 86.7%와 77.8%이며, 이 경우 최소 표본크기는 각각 288명씩 총 576명이었다.
한편, 영양섭취와 관련하여 본 연구에서는 에너지, 단백질, 지방, 탄수화물, 식이섬유 섭취를 고려하였다. 그러나, 최근 보고에 따르면 폐경 여성에서 호르몬 변화로 나타나는 지질대사나 에너지 대사를 고려하여 충분한 단백질(1.0~1.2 g/kg/일) 섭취와 함께 추가적으로 비타민 D, 오메가-3 지방산, 항산화제 등의 섭취가 권장되고 있어[44], 이러한 영양소의 섭취 상태와 이상지질혈증 발생간의 관계를 파악하는 연구가 필요하다. 또한, 국내 일개 대학병원의 건강증진센터를 방문한 폐경 여성을 대상으로 한 연구에서 적혈구침강속도, 총 빌리루빈, 요산, 공복혈당, 백혈구 수치가 LDL-C와 관련이 있음[45]이 보고되어 이상지질혈증과 관련된 생리적 지표를 확인하기 위한 연구 또한 필요할 것으로 생각된다.
이상지질혈증은 심혈관질환의 주요 위험요인이며, 폐경은 이상지질혈증 발생과 관련이 있으나, 시간적 경과에 따른 발생수준, 발생시기, 위험요인에 대한 연구는 부족한 실정이다. 본 연구를 통해 폐경 여성에서 이상지질혈증은 매우 흔하며, 폐경 후 5년 이내에 이상지질혈증이 호발함을 알 수 있으며, 또한 이러한 발생과정에서는 폐경 당시 TG/HDL-C의 수준이 주요하게 영향을 미치는 것을 알 수 있다. 따라서, 보건의료기관에 근무하는 간호사는 본 연구 결과를 고려하여 폐경 여성을 대상으로 혈중 지질 모니터링의 중요성을 교육하며, TG/HDL-C이 높은 고위험군을 대상으로 적극적인 혈중 지질 감소 중재를 제공할 필요가 있다. 본 연구는 40대 이상 여성이 포함된 지역사회 기반 코호트 연구를 활용함에 따라, 연구 결과를 다양한 연령층이나 지역으로 일반화하는 데는 제한점이 있다. 따라서, 간호연구자는 40대 이전의 조기폐경 여성을 포함하여 다양한 지역에 거주하는 여성을 대상으로 반복적 연구를 실시하기를 제언한다. 마지막으로, 정책 입안자의 경우 국내 여성의 폐경 연령을 고려하여 50대 이후 여성의 경우 약 5년간은 연 1회 혈중 지질 검사에 대해 건강보험을 적용하는 등 적극적인 혈중 지질 모니터링을 통한 조기 중재가 가능하도록 하는 정책적 방향을 설정하는 데 활용할 수 있다.
본 연구의 장점으로 첫째, 폐경과 이상지질혈증 발생양상이나 위험요인을 파악한 연구가 부족한 실정에서 이에 대한 근거를 추가하였다. 이상지질혈증은 대사증후군의 한 요소[10]로 또는 독립적으로[13] 폐경과의 관계가 연구되고 있으나, 대부분이 단면조사 연구로 폐경 후 이상지질혈증 발생양상을 보고한 연구는 매우 제한적이다. 본 연구는 지역사회 기반 코호트의 종단적 추적자료를 활용하여 폐경 후 이상지질혈증 발생수준과 발생시기, 폐경 연령에 따른 발생양상의 차이, 그리고, 폐경 후 이상지질혈증 발생 위험요인 등을 다각적으로 확인하였다는 점에서 의의가 있다. 둘째, 폐경 후 2년 이내의 여성만을 대상으로 함에 따라 폐경 후 시간적 경과에 따른 대상자 특성 변화를 최소화하고, 폐경 후 이상지질혈증 발생시기의 정확성을 제고하였다. 셋째, 이상지질혈증을 진단함에 있어 의사진단과 약물복용에 대한 자가보고 자료와 함께 혈액검사를 통한 혈중 지질 등 주관적·객관적 자료를 모두 활용하였으며, 혈중 지질의 지표로 TC, TG, HDL-C 등 3가지를 활용하여 가능한 민감도를 높이고자 하였다. 넷째, 기반조사 당시 경계수준 또는 정상수준의 혈중 지질이 시간적 경과에 따라 이상지질혈증 발생에 얼마나 영향을 주는 지를 확인하였다. 다섯째, 이상지질혈증 발생 위험요인을 파악함에 있어 혈중 지질의 개별 지표는 물론 이들을 조합한 지표를 동시에 고려하였다. 이상지질혈증과 심혈관질환 위험간의 관계를 파악함에 있어, 혈중 지질에 대한 개별 지표(예: TG, HDL-C)보다 이들을 조합하여 비(ratio)로 구성한 지표(예: TG/HDL-C)가 더 좋은 예측지표로 알려져 있다. 특히, TG/HDL-C는 서로 역상관 관계에 있는 2가지 지표를 조합한 것으로, 심혈관질환 예측, 대사증후군의 주요 원인인 인슐린 저항성을 예측하는 데 좋은 지표가 된다[34]. 마지막으로, 기반조사와 관찰 종료시점에서의 대상자 특성의 차이에 대한 추가분석을 통해 폐경 후 이상지질혈증 위험요인인 TG/HDL-C은 기반조사나 관찰종료 시점에서 유의한 변화가 없어 비교적 안정적인 지표임을 확인하였다.
이러한 장점에도 불구하고 연구 결과를 해석함에 있어 다음과 같은 제한점에 주의할 필요가 있다. 첫째, 이상지질혈증을 정의함에 있어 LDL-C를 고려하지 못하였으며, 이로 인한 대상자 선정편견이 있을 수 있다. LDL-C는 죽상경화증 심질환의 주요 위험요인이며[46], 이상지질혈증을 정의하는 데 중요한 지표이지만 직접 측정이 아닌 Friedewald equation에 의한 계산으로 구하는 경우 정확성이 낮으며[47], 본 연구에서도 계산된 LDL-C 중 일부에서 음의 값을 갖는 등 타당성을 확보하는 데 어려움이 있었다. 최근 LDL-C의 대안으로 non-HDL-C를 사용하고 있으나, 절단점이 임의적이라는 한계가 있으며[47], 국내 연구[34]에 제시한 non-HDL 절단점에서는 곡선하면적이 .62 (.58~.67)에 불과하고 민감도 69.3%, 특이도 52.6%로 타당성이 낮아 본 연구에서는 이상지질혈증 진단기준으로 LDL-C와 non-HDL-C를 제외하였다. 둘째, 운동은 지질 소비를 증가시켜 혈중 지질을 떨어뜨리며, 적극적인 유산소 운동은 혈중 지질 지표를 개선하는 효과가 있는 것으로 알려지고 있다[22, 48]. 그러나, KoGES 반복 추적조사의 기반조사에서는 peak metabolic equivalents를 고려한 신체활동량을, 이후 추적조사에서는 운동 여부나 땀을 흘릴 정도의 운동 여부 등 조사항목에 차이가 있어 본 연구에서는 설명변수에서 제외되었다. 셋째, 일 코호트 연구에서 자연적으로 또는 외과적 수술로 인해 40세 이전에 조기폐경된 여성은 40세 이후 폐경된 여성에 비해 이상지질혈증의 위험이 1.36~2.13배 증가하는 것[49]으로 나타나 40세 이전과 이후 폐경에 따라 이상지질혈증의 발생률이 달라질 수 있음을 보고하였다. 그러나, KoGES 조사는 40세 이후 남녀를 대상으로 하였으며, 본 연구에 포함된 대상자는 모두 40대 이상이므로 본 연구결과를 40대 이전의 폐경 여성까지 일반화하는 데는 제한점이 있다.
결론
본 연구에서 지역사회에 거주하는 40대 이상의 여성을 최대 16년간 추적조사하는 경우 100명 중 약 78명이 이상지질혈증이 발생하여 폐경 여성에서 이상지질혈증이 매우 빈번히 발생함을 알 수 있다. 이상지질혈증이 발생한 대상자의 50%는 5~6년 발생하여 폐경 후 비교적 이른 시기에 이상지질혈증이 발생하며, 폐경 당시 혈중 지질 중 TG/HDL-C과 밀접히 관련되어 있다. 폐경 후 이상지질혈증 발생률과 발생시기는 40대 폐경과 50대 폐경에 상관없이 유사한 경향을 보여, 40대 이후 폐경 여성이라면 폐경 직후부터 적어도 5년까지는 지속적인 혈중 지질에 대한 모니터링과 함께 적정수준의 혈중 지질을 유지하기 위한 생활습관이 필요함을 알 수 있다. 특히, 폐경 당시 TG/HDL-C이 높은 여성은 이상지질혈증의 고위험군으로 그렇지 않은 여성에 비해 좀 더 적극적인 혈중 지질관리 중재가 요구된다.
SUPPLEMENTARY DATA
Supplementary data to this article can be found online at https://doi.org/10.4040/jkan.21188.
The flowchart for the subject selection.Supplementary Figure 1
Spearman Correlation Coefficient among VariablesSupplementary Table 1
Survival curve of dyslipidemia onset according to age at menopause.Supplementary Figure 2
Comparison of Subjects’ Characteristics at End of Follow-Up according to Dyslipidemia Onset (N = 245)Supplementary Table 2
CONFLICTS OF INTEREST:The authors declared no conflict of interest.
AUTHOR CONTRIBUTIONS:
Conceptualization or/and Methodology: Jeong IS.
Data curation or/and Analysis: Jeong IS & Yun HS & Kim MS & Hwang YS.
Funding acquisition: None.
Investigation: None.
Project administration or/and Supervision: Jeong IS.
Resources or/and Software: Jeong IS.
Validation: Jeong IS & Yun HS.
Visualization: Jeong IS & Yun HS.
Writing original draft or/and Review & Editing: Jeong IS & Yun HS & Kim MS & Hwang YS.
ACKNOWLEDGEMENTS
None.
DATA SHARING STATEMENT
Data in this study were from the Korean Genome and Epidemiology Study (KoGES; 4851-302), National Research Institute of Health, Centers for Disease Control and Prevention, Ministry for Health and Welfare, Republic of Korea.
References
-
Statistics Korea. 2019 causes of death statistics [Internet]. Daejeon: Statistics Korea; c2020 [cited 2021 Jul 28].Available from: http://kostat.go.kr/portal/korea/kor_
nw/1/6/2/index.board?bmode=read&bSeq=&aSeq=385219&pageNo=1&rowNum=10&navCount=10&currPg=&searchInfo=&sTarget=title&sTxt= .
-
-
Halcox JP, Banegas JR, Roy C, Dallongeville J, De Backer G, Guallar E, et al. Prevalence and treatment of atherogenic dyslipidemia in the primary prevention of cardiovascular disease in Europe: EURIKA, a cross-sectional observational study. BMC Cardiovascular Disorders 2017;17(1):160 [doi: 10.1186/s12872-017-0591-5]
-
-
Xing L, Jing L, Tian Y, Yan H, Zhang B, Sun Q, et al. Epidemiology of dyslipidemia and associated cardiovascular risk factors in northeast China: A cross-sectional study. Nutrition Metabolism and Cardiovascular Diseases 2020;30(12):2262–2270. [doi: 10.1016/j.numecd.2020.07.032]
-
-
Ministry of Health and Welfare (MOHW). Korean Disease Control and Prevention Agency (KDCA). Korea health statistics 2019: Korea National Health and Nutrition Examination Survey (KNHANES VIII-1). Cheongju: KDCA; 2020 Dec. pp. 311.Report No.: 11-1351159-000027-10.
-
-
Ley SH, Li Y, Tobias DK, Manson JE, Rosner B, Hu FB, et al. Duration of reproductive life span, age at menarche, and age at menopause are associated with risk of cardiovascular disease in women. Journal of the American Heart Association 2017;6(11):e006713 [doi: 10.1161/JAHA.117.006713]
-
-
Kane SP. Sample size calculator [Internet]. USA: ClinCalc; c2014 [cited 2021 Oct 21].Available from: https://clincalc.com/Stats/SampleSize.aspx .
-
-
Ohta T, Nagashima J, Sasai H, Ishii N. Relationship of cardiorespiratory fitness and body mass index with the incidence of dyslipidemia among Japanese women: A cohort study. International Journal of Environmental Research and Public Health 2019;16(23):4647 [doi: 10.3390/ijerph16234647]
-
-
Korean Academy of Medical Sciences (KAMS). Korea Disease Control and Prevention Agency (KDCA). Evidence-based guideline for dyslipidemia in primary care. 3rd rev. ed. Seoul: KAMS; 2019. pp. 30.
-
-
Zhang M, Deng Q, Wang L, Huang Z, Zhou M, Li Y, et al. Prevalence of dyslipidemia and achievement of low-density lipoprotein cholesterol targets in Chinese adults: A nationally representative survey of 163,641 adults. International Journal of Cardiology 2018;260:196–203. [doi: 10.1016/j.ijcard.2017.12.069]
-
-
Korean Statistical Information Service (KOSIS). Monthly average household balance per household by number of household members [Internet]. Daejeon: Statistics Korea; 2020 [cited 2021 Jun 22].
-
-
Seo MH, Lee WY, Kim SS, Kang JH, Kang JH, Kim KK, et al. 2018 Korean Society for the Study of Obesity guideline for the management of obesity in Korea. Journal of Obesity & Metabolic Syndrome 2019;28(1):40–45. [doi: 10.7570/jomes.2019.28.1.40]
-
-
Korea Centers for Disease Control and Prevention (KCDC). The Korean Genome and Epidemiology Study (KoGES): Nutrition examination. Cheongju: KCDC; 2011. pp. 14.
-
-
Hong SB, Shin KA. Significance of non HDL-cholesterol and triglyceride to HDL-cholesterol ratio as predictors for metabolic syndrome among Korean elderly. Korean Journal of Clinical Laboratory Science 2018;50(3):245–252. [doi: 10.15324/kjcls.2018.50.3.245]
-
-
Opoku S, Gan Y, Fu W, Chen D, Addo-Yobo E, Trofimovitch D, et al. Prevalence and risk factors for dyslipidemia among adults in rural and urban China: Findings from the China National Stroke Screening and Prevention Project (CNSSPP). BMC Public Health 2019;19(1):1500 [doi: 10.1186/s12889-019-7827-5]
-
-
Sadeghi M, Talaei M, Oveisgharan S, Rabiei K, Dianatkhah M, Bahonar A, et al. The cumulative incidence of conventional risk factors of cardiovascular disease and their population attributable risk in an Iranian population: The Isfahan Cohort Study. Advanced Biomedical Research 2014;3:242 [doi: 10.4103/2277-9175.145749]
-
-
Latifi SM, Karandish M, Shahbazian HB, Chinipardaz R, Sabet A, Pirani N. A survey of the incidence of dyslipidemia and its components in people over 20 years old in Ahvaz: A cohort study 2009-2014. Diabetes & Metabolic Syndrome 2017;11 Suppl 2:S751–S754. [doi: 10.1016/j.dsx.2017.05.010]
-
-
Fingeret M, Marques-Vidal P, Vollenweider P. Incidence of type 2 diabetes, hypertension, and dyslipidemia in metabolically healthy obese and non-obese. Nutrition Metabolism and Cardiovascular Diseases 2018;28(10):1036–1044. [doi: 10.1016/j.numecd.2018.06.011]
-
-
Kim J, Park S. Association between age at natural menopause and prevalence of obesity, hypertension, diabetes, and hypercholesterolemia. Korean Public Health Research 2021;47(1):1–9. [doi: 10.22900/kphr.2021.47.1.001]
-
-
Muka T, Oliver-Williams C, Kunutsor S, Laven JS, Fauser BC, Chowdhury R, et al. Association of age at onset of menopause and time since onset of menopause with cardiovascular outcomes, intermediate vascular traits, and all-cause mortality: A systematic review and meta-analysis. JAMA Cardiology 2016;1(7):767–776. [doi: 10.1001/jamacardio.2016.2415]
-
-
Jia L, Long S, Fu M, Yan B, Tian Y, Xu Y, et al. Relationship between total cholesterol/high-density lipoprotein cholesterol ratio, triglyceride/high-density lipoprotein cholesterol ratio, and high-density lipoprotein subclasses. Metabolism 2006;55(9):1141–1148. [doi: 10.1016/j.metabol.2006.04.004]
-
-
Ko SH, Kim HS. Menopause-associated lipid metabolic disorders and foods beneficial for postmenopausal women. Nutrients 2020;12(1):202 [doi: 10.3390/nu12010202]
-
-
Jung D, Choi HJ, Shim YN, Jo MS, Oh HJ. Predictors of serum low-density lipoprotein cholesterol level in postmenopausal women. Korean Journal of Family Practice 2020;10(5):393–397. [doi: 10.21215/kjfp.2020.10.5.393]
-
 KSNS
KSNS
 E-SUBMISSION
E-SUBMISSION

 Cite
Cite