Articles
- Page Path
- HOME > J Korean Acad Nurs > Volume 51(3); 2021 > Article
- Research Paper Influences of Autonomic Function, Salivary Cortisol and Physical Activity on Cognitive Functions in Institutionalized Older Adults with Mild Cognitive Impairment: Based on Neurovisceral Integration Model
- Minhee Suh
-
Journal of Korean Academy of Nursing 2021;51(3):294-304.
DOI: https://doi.org/10.4040/jkan.20282
Published online: June 30, 2021
Abstract
Purpose
This study aimed to investigate objectively measured physical activity (PA) in institutionalized older adults with mild cognitive impairment (MCI) and to elucidate the influence of autonomic nervous function, salivary cortisol, and PA on cognitive functions based on neurovisceral integration model.
Methods
Overall cognitive function was evaluated using the mini-mental state examination (MMSE) and executive function was evaluated using semantic verbal fluency test and clock drawing test. Actigraph for PA, HRV and sAA for autonomous function, and the geriatric depression scale for depression were used. Saliva specimens were collected in the morning for sAA and cortisol.
Results
Ninety-eight older adults from four regional geriatric hospitals participated in the study. They took 4,499 steps per day on average. They spent 753.93 minutes and 23.12 minutes on average in sedentary and moderate-to-vigorous activity, respectively. In the multiple regression analysis, lower salivary cortisol level (β = - .33, p = .041) and greater step counts (β = .37, p = .029) significantly improved MMSE score. Greater step count (β = .27, p = .016) also exerted a significant influence on verbal fluency, and greater sAA (β = .35, p = .026) was significantly associated with a better clock drawing test result.
Conclusion
Salivary cortisol, sAA and physical activity were significantly associated with cognitive functions. To prevent older adults from developing dementia, strategies are needed to increase their overall PA amount by decreasing sedentary time and to decrease salivary cortisol for cognitive function, and to maintain their sympathetic nervous activity for executive function.
Published online Jun 30, 2021.
https://doi.org/10.4040/jkan.20282
Abstract
Purpose
This study aimed to investigate objectively measured physical activity (PA) in institutionalized older adults with mild cognitive impairment (MCI) and to elucidate the influence of autonomic nervous function, salivary cortisol, and PA on cognitive functions based on neurovisceral integration model.
Methods
Overall cognitive function was evaluated using the mini-mental state examination (MMSE) and executive function was evaluated using semantic verbal fluency test and clock drawing test. Actigraph for PA, HRV and sAA for autonomous function, and the geriatric depression scale for depression were used. Saliva specimens were collected in the morning for sAA and cortisol.
Results
Ninety-eight older adults from four regional geriatric hospitals participated in the study. They took 4,499 steps per day on average. They spent 753.93 minutes and 23.12 minutes on average in sedentary and moderate-to-vigorous activity, respectively. In the multiple regression analysis, lower salivary cortisol level (β = − .33, p = .041) and greater step counts (β = .37, p = .029) significantly improved MMSE score. Greater step count (β = .27, p = .016) also exerted a significant influence on verbal fluency, and greater sAA (β = .35, p = .026) was significantly associated with a better clock drawing test result.
Conclusion
Salivary cortisol, sAA and physical activity were significantly associated with cognitive functions. To prevent older adults from developing dementia, strategies are needed to increase their overall PA amount by decreasing sedentary time and to decrease salivary cortisol for cognitive function, and to maintain their sympathetic nervous activity for executive function.
서 론
1. 연구의 필요성
경도 인지장애(mild cognitive impairment)는 정상 인지기능에서 치매로 이환되는 중간단계로 약 30% 정도가 치매로 발전하게 되므로 치매 예방의 중요한 단계이다[1]. 노인요양병원에 입원한 노인의 경우 주변 환경 변화와 제한된 생활 패턴 등으로 인해 인지 기능이 더 취약해질 가능성이 높다. 선행연구에 의하면 노인요양병원 입원 노인의 인지기능은 지역사회 거주 노인에 비해 감소되며[2] 병원 입원 기간 동안에 악화된 인지 기능은 퇴원 후에도 회복되기 어렵거나 더 악화된다고 보고하였다[3]. 또한 노인요양병원 입원 노인들은 급성 질환이나 다양한 약물 사용 등으로 인해 급격한 생리적, 신체적 변화를 겪게 되므로 이를 고려하여 인지기능을 저하 요인을 규명해야 한다. 따라서 노인요양병원 입원 중인 경도 인지장애 노인들의 인지기능 관련 요인을 사전에 파악하고 인지기능 저하를 예측 및 예방하는 것이 필요하다.
Neuroviseral integration (NVI) 모델[4]에 의하면 고위 인지기능을 담당하는 중추신경계인 전전두엽 피질(prefrontal cortex)기능, 심혈관 기능을 담당하는 자율신경계 활성을 반영하는 심박변이도(heart rate variability)와 인지적 수행(cognitive performance)이 서로 연관되어 목적 지향적인 행동을 수행하는 데 기여한다. 이러한 중추신경계와 자율신경계의 연결을 담당하는 뇌의 부위를 중추 자율신경 연결부(central autonomic network [CAN])라고 하는데 여기에는 전대상피질(anterior cingulate cortex), 뇌섬엽(insula), 편도체(amygdala) 등 뇌의 여러 부위가 속한다. 중추 자율신경 연결부 부위 중 편도체는 전전두엽을 비롯한 여러 대뇌 피질 부위와 기능적으로 긴밀히 연결되어 정서 조절에 관여하는데, 이러한 기능적 연결에도 자율신경계 기능이 관련되는 것으로 보고된 바 있다[5]. 최근 연구에서도 교감신경 활성이 감소되어 심박출량이 낮은 저혈압 환자군이 인지기능 중 복잡한 처리 과정을 가진 하부 인지기능인 실행 기능(executive function) 평가 시 정상 혈압군에 비해 유의하게 높은 실수율을 보였다[6].
심박변이도, 타액 알파아밀라아제(salivary alpha-amylase)와 같은 생리적 지표는 자율신경계 활성도를 반영한다. 심박변이도는 심박동 사이의 미세한 변이를 측정하여 중추신경계와 연계된 교감신경과 부교감신경의 활성 정도를 반영한다[7]. 알파아밀라아제는 스트레스하에 침샘에서 분비되는 효소로 교감신경 활성도를 반영하며 타액에서 측정할 수 있다[8]. 이러한 생리적 지표는 모두 자율신경계의 활성과 연관된 것으로 중추신경계와 다양하게 관련될 수 있을 것으로 생각되는데, 심박변이도의 경우 뇌혈류랑 저하나 전두엽 피질의 기능에 영향을 주는 것으로 보고된 바 있다[9, 10].
뿐만 아니라 시상하부-뇌하수체-부신축(hypothalamic-pituitary-adrenal axis [HPA axis])의 말단에서 분비되는 코티졸 호르몬 또한 분비 경로 중 중추 자율신경 연결부와 연계되는 시상하부를 공유하며 HPA axis 가 해마에 의해 억제되는 점으로 볼 때[11], 코티졸 수준은 인지기능과 관련이 있을 수 있을 것으로 생각된다. 코티졸과 인지기능의 관련성을 메타 분석한 최근의 논문을 보면, 알츠하이머 치매 환자에서 코티졸과 인지기능의 관련성은 어느 정도 보고되고 있으나 경도 인지장애 대상자에서는 그 관련성이 다소 상반된 결과를 보이고 있다[12].
노인의 우울과 신체활동 역시 인지기능에 영향을 주는 것으로 알려져 있다. 우울과 같은 감정이나 신체활동 및 운동을 통한 심폐 건강은 중추신경계, 특히 중추 자율신경 연결부 부위와 관련되는 것으로 보고된 바 있다[13]. 노인요양병원 입원 노인은 취약한 신체적 상태나 생활 반경의 제한으로 인해 일상적인 신체활동량이 감소될 것으로 생각되므로 이들의 신체활동 정도를 파악하고 인지기능과의 관련성을 조사할 필요가 있다. 그러나 기존 신체활동과 인지기능 연구에서는 짧은 보행거리와 보행 소요시간을 측정하거나 설문지를 이용하여 신체활동 능력을 파악한 경우가 많았으며[14, 15], 웨어러블 센싱 기기를 이용하여 일상적인 신체활동량을 측정하고 인지 기능과의 관련성을 조사한 연구는 최근의 해외 연구에서 일부 찾아볼 수 있을 뿐, 국내 연구에서는 찾아보기 어렵다. 노인들의 저하된 기억력을 고려했을 때, 회상에 기반한 설문조사보다는 웨어러블 센싱 기기를 이용해 객관적으로 이들의 신체활동 양상을 파악하고, 신체활동과 인지기능과의 연관성을 조사할 필요가 있다.
따라서 본 연구는 노인요양병원에 입원 중인 경도 인지장애 노인들의 일상적인 신체활동 양상을 웨어러블 센싱 기기를 이용하여 객관적으로 파악하고, 자율신경계 기능과 스트레스를 반영하는 생리적 지표로서 심박변이도, 타액 알파아밀라아제 및 타액 코티졸과 신체활동 정도가 인지기능에 미치는 영향을 규명하고자 한다.
2. 연구 목적
본 연구의 목적은 노인요양병원에 입원 중인 경도 인지장애 노인들의 일상적인 신체활동 양상을 웨어러블 기기를 이용하여 파악하고, 심박변이도와 타액 알파아밀라아제, 타액 코티졸과 신체활동 정도가 인지기능에 미치는 영향을 분석하는 것이다.
연구 방법
1. 연구 설계
본 연구는 입원 중인 경도 인지장애 노인들의 자율신경계 기능, 타액 코티졸 수준 및 신체활동 양상을 파악하고 이들이 인지기능에 미치는 영향을 분석하기 위한 서술적 조사 연구이다.
2. 연구 대상
연구 대상자는 경기도 지역에 위치한 4개의 노인요양병원에 입원 중인 65세 이상 노인 98명으로 연구 참여에 동의한 대상자들이다. 대상자 선정 기준은 학력, 나이, 성별을 고려하여 판단한 치매 선별용 간이정신상태검사(Mini-Mental State Examination for Dementia Screening [MMSE-DS]) 점수[16]상 치매가 아니나 “현재 자신의 기억력에 문제가 있다고 생각하십니까?”라는 질문에 “그렇다”라고 답하여 주관적인 기억력의 장애를 호소하는자[17], 의사소통이 가능하고 거동이 가능한 자, 입원한지 1주일 이상이 된 자, 현재 심전도상 부정맥을 보이지 않는 자였다. 또한 정확한 심박변이도 측정을 위해 측정 24시간 전부터는 카페인, 니코틴, 알코올 섭취를 제한하였으며, 타액 검체 채취 1시간 전에는 음식물 섭취나 양치질, 가글액 이용을 하지 않도록 하였다.
연구 대상자 수는 G-power 3.1.9를 이용하여 산정하였다[18]. 인지기능에 영향을 미치는 요인을 파악하기 위해 다변량 선형회귀분석(multiple linear regression) 통계를 기준으로 유의수준 .05, 검정력 0.80, 예측변수 8개로 설정하고, de Oliveira Matos 등[19]의 연구에서 제시된 R2을 사용한 효과크기를 0.17로 하였을 때 필요한 최소 대상자 수는 96명이었다. 본 연구에서는 총 98명의 대상자를 조사하였다.
3. 연구 도구
1) 인지기능
대상자들의 전반적인 인지기능을 측정하기 위해 MMSE-DS를 이용하였다[16]. 이 도구는 시간 지남력 5점, 장소 지남력 5점, 기억 등록 3점, 주의집중 및 계산 5점, 기억 회상 3점, 언어 능력 8점, 그리기 1점으로 구성되어 있으며, 30점 만점으로 점수가 높을수록 인지 기능이 좋음을 의미한다.
하부 인지기능 중의 하나인 실행 기능을 평가하기 위해 의미적 언어유창성 검사(semantic verbal fluency test)와 시계 그리기 검사(clock drawing test)를 이용하였다. 의미적 언어유창성 검사는 알츠하이머병의 초기부터 손상되기 시작하는 전두엽과 측두엽의 실행 기능을 평가할 수 있는 검사로 인정되고 있다[20]. 대상자에게 1분간 동물 범주에 속하는 단어를 최대한 많이 말하도록 하고 대상자가 말한 단어를 모두 기록지에 기록한다. 반복적으로 나온 단어나 동물범주에 속하지 않는 단어는 제외한 후, 1분간 말한 단어의 개수를 평가하여 올바르게 말한 단어의 개수가 많을수록 실행 기능이 좋음을 의미한다[21]. 시계 그리기 검사는 대상자로 하여금 종이에 시계를 그리고 특정 시간의 시계바늘을 그려 표시하도록 하는 검사로, 의미적 지식 및 시공간 구성능력, 집행기능을 민감하게 측정할 수 있으며 타당도와 신뢰도가 확보된 바 있다[22]. 검사 결과를 평가하기 위해서 Rouleau 점수 체계를 적용하였다[23]. Rouleau 점수 체계는 시계판의 모양 2점, 숫자의 배열 4점, 시계 바늘의 정확성 4점으로 평가하여 점수 범위는 0~10점이며 점수가 높을수록 실행 기능이 좋은 상태를 의미한다.
2) 심박변이도
심박변이도는 이동식 심박변이도 측정 기기인 Heart Rhythm Scanner 3.0 (Biocom Technologies, Poulsbo, WA, USA)을 이용하여 측정하였다[24]. 연구 대상자를 침상에 눕게 한 상태에서 좌우 손목 내측 부위에 각각 전극을 부착하고 침상 머리를 높여 앉은 자세를 취하게 하였다. 앉은 자세에서 5분간 안정을 취한 후 5분간 심박변이도를 측정하였다. 심박변이도의 일중 리듬을 고려하여 모든 대상자의 심박변이도를 오전 9시에서 11시 사이에 측정하였다. 측정된 심박변이도 신호로부터 심혈관계의 안정도와 심장 리듬의 반응성을 나타내는 지표인 심박표준편차(standard deviation of normal normal-to-normal intervals [SDNN]), 부교감신경의 활성을 나타내는 시간 영역 지표인 연속한 R-R 간격 차이 값의 평균제곱근(root mean square of the differences between adjacent RR intervals [RMSSD]), 교감신경의 활성도를 반영하는 주파수 영역 지표인 표준 저주파 전력(normalized low frequency [nLF]), 부교감신경의 활성도를 반영하는 주파수 영역 지표인 표준 고주파 전력(normalized high frequency [nHF]), 고주파 전력과 저주파 전력의 비율(LF/HF ratio)을 산출하였다.
3) 타액 알파아밀라아제 및 코티졸 측정
타액 검체는 Salimetrics 사의 oral swab (P/N5001.02; State College, PA, USA) 수집 용기를 이용하여 수집하였다. 대상자는 수집 용기 내의 목화솜을 입에 물고 씹으면서 설하샘(subligual gland), 하악샘(submandibular gland), 이하샘(parotid gland)에서 분비되는 타액을 목화솜에 충분히 흡수시킨 후 다시 수집 용기에 목화솜을 뱉도록 하였다[25]. 알파아밀라아제와 코티졸의 일중 변동을 고려하여 오전 9시에서 11시 사이에 일괄적으로 수집하였으며 수집된 검체는 즉시 아이스박스에 보관하고, 24시간 내에 영하 70도의 냉동고로 옮겨서 보관하였다. 타액 내 알파아밀라제 및 코티졸을 분석하기 위해서 검체 분석을 임상검사 전문의료기관인 녹십자랩셀에 의뢰하였다. 알파아밀라아제 분석에는 Salimetrics salivary alpha-amylase assay kit (Catalog No. 1-1902; Salimetrics)이, 코티졸 분석에는 Enzyme Immunoassay Kit (HS salivary cortisol EIA kit; Salimetrics)가 이용되었으며 분석 과정은 Salimetrics 사에서 제시한 프로토콜에 따라 진행되었다.
4) 신체활동 측정
신체활동은 웨어러블 액티그래프 기기인 액티그래프 GT3X(ActiGraph LLC, Pensacola, FL, USA)를 이용하여 측정하였다. 이 기기는 신체활동 연구를 위해 개발된 기기로 3개의 축에서 신체활동을 측정하여 자세 및 활동량 정보를 수집한다. 액티그래프는 대상자의 주로 쓰지 않는 손의 손목에 3~4일간 착용하게 하여 측정하였으며, 신체활동은 30 Hz에서 1분 간격으로 측정하였다. 이 기기를 이용한 신체활동 측정의 신뢰도는 비교적 안정적인 것으로 보고된 바 있다[26].
액티그래프로 측정된 자료는 ActiLife 6.13.4 software (ActiGraph LLC)를 이용해 분석하였다. 미착용 시간을 분석에서 제외하기 위해서 Choi의 알고리즘을 이용하여[27] 착용시간을 추출한 후, 일 평균 걸음 수, 정적 활동 및 저강도/중도/고강도 활동의 비율을 산출하였다. 정적 활동 및 저강도/중도/고강도 활동의 비율 산출에는 기기에서 측정된 측정 단위(counts/minute[CPM])에 Freedson adult 알고리즘을 적용하여[28] 분석하였다. 0~99 CPM은 정적 활동, 100~1,951 CPM은 저강도의 활동, 1,952~5,724 CPM은 중등도의 활동, 5,725 CPM 이상의 활동은 고강도 활동으로 분석하였다. 측정한 기간 동안의 평균치를 산출하여 분석에 이용하였다.
4. 자료수집 절차
자료수집은 2018년 7월부터 2020년 1월의 기간에 진행되었다. 연구 대상자를 모집하기 위해 연구자가 임의로 선정한 4개의 노인요양병원 책임자에게 연락하여 자료수집 협조를 요청하고 승낙을 받았다. 해당 기관들의 담당자가 병원에 입원한 환자 중 대상자 선정 조건에 맞는 대상자를 추출하여 명단을 연구자에게 제공하면, 연구자가 명단에 있는 대상자를 찾아가 연구에 대해 설명하고 연구 참여를 권유하였다. 연구에 대한 설명을 듣고 서면 동의서에 서명한 대상자에 한해 자발적으로 연구에 참여하도록 하였다. 대상자와 약속한 일자에 연구 보조원이 대상자의 병실로 방문하여, 오전 시간에 약 30~40분간 대상자의 심박변이도 측정 및 오전 타액 검체 수집을 진행하였다. 대상자에게 휴식을 취하게 한 후, 오후에 다시 방문하여 인지기능 검사를 시행하고 인구학적 정보를 수집하였으며 우울감을 측정하였다. 오후 자료수집에는 약 30분의 시간이 소요되었다. 자료 수집을 완료한 대상자에게는 소정의 선물을 증정하였다. 이후 의무기록 열람을 통해 대상자의 체중과 신장 정보, 진단명을 조사하였다.
측정자 간 신뢰도를 확보하기 위해 사전에 1시간에 걸쳐 3인의 연구 보조원에게 자료수집 방법 및 절차에 대해 교육하였다. 또한 연구 보조원 3인이 4명의 대상자를 함께 방문하여 심박변이도 측정, 웨어러블 기기 착용, 인지기능 검사 및 판정, 우울감 조사를 시행한 후, 연구자와 논의를 통해 방법 및 절차상의 세부사항을 함께 조율하는 과정을 거쳤다.
5. 자료분석 방법
본 연구에서 수집된 자료는 IBM SPSS Statistics ver. 25 for Windows (IBM Corp., Armonk, NY, USA) 통계프로그램을 이용하여 분석하였다. 대상자의 인구학적/임상적 정보와 인지기능, 심박변이도, 타액 알파아밀라아제와 코티졸 수치, 신체활동 지표, 우울감은 기술통계를 이용하여 빈도와 백분율, 평균과 표준편차로 제시하였다. 연구 변수들의 정규성 검정을 위해 왜도와 첨도의 절대값을 확인하였으며 왜도 ± 2 이상, 첨도 ± 10 이상인 변수들은 로그변환 후 분석에 이용하였다. 인지기능에 영향을 주는 요인을 확인하기 위해서 다중선형회귀분석을 시행하였다. 다중선형회귀 분석에 포함할 변수를 확인하기 위해 상관관계 분석을 시행한 후, 상관관계 분석에서 통계적 유의수준이 p < .25로 나타난 변수를 다중선형회귀분석에 투입하였다. 통계적 유의수준은 p < .05를 기준으로 하였다.
6. 윤리적 고려
연구의 자료 수집을 진행하기 전에 본 연구의 내용과 방법에 대하여 인하대학교 기관생명윤리위원회의 승인을 받았다(IRB No. 180511-1AR). 대상자들의 자발적인 참여를 바탕으로 연구대상자가 선정되었으며 선정된 대상자들에게 연구의 목적과 절차, 연구 참여 시 주의사항, 개인 정보 및 검체 이용에 대해 설명한 후 서면 동의서를 작성하였다. 허약한 대상자들의 특징을 고려하여 충분한 시간적 여유와 휴식을 제공하면서 자료 수집을 진행하였고, 중도에 철회를 요구한 대상자의 경우 즉시 진행을 중지하였다. 개인정보 보호를 위해 수집된 자료와 검체는 익명화 및 코드화하여 잠금장치를 적용해 보관하였다.
연구 결과
1. 대상자의 일반적 특성
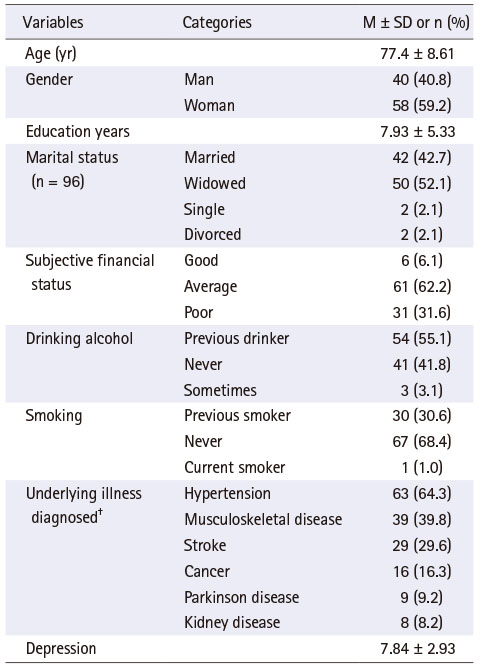
본 연구 대상자들의 특성은 Table 1에 기술되어 있다. 대상자들의 평균 연령은 77.4세로 총 98명의 대상자 중 여성이 58명(59.2%)이었다. 평균 교육 연한은 약 7.93년이었고 주관적인 경제 상태는 61명(62.2%)이 평균 정도, 31명(31.6%)이 어려운 편이라고 답하였다. 거의 대부분이 현재는 음주나 흡연을 하고 있지 않으나, 54명(55.1%)은 이전에 정기적으로 음주를 했었고, 30명(30.6%)은 이전에 정기적으로 흡연을 했던 경험이 있었다. 가장 많이 가지고 있는 질환은 고혈압과 퇴행성 관절염 등의 근골격계 질환으로, 63명(64.3%)의 대상자들이 고혈압을, 39명(39.8%)이 근골격계 질환을 진단받은 상태였다. 우울감을 측정한 결과는 평균 7.84점이었다.
Table 1
General Characteristics of the Participants (N = 98)
2. 대상자들의 인지기능, 생리적 지표, 우울 및 신체활동
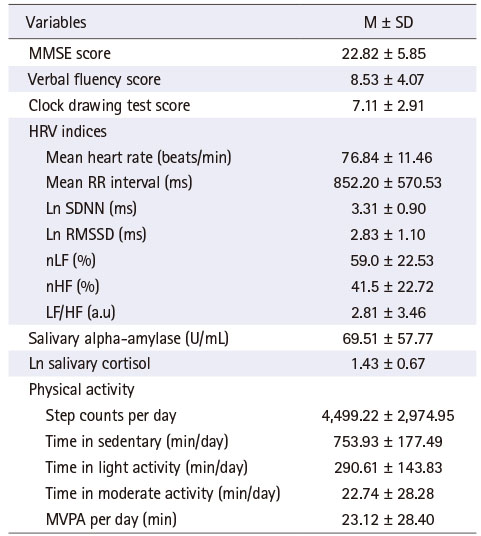
인지기능 평가 결과, 전반적인 인지기능을 반영하는 MMSE 점수는 22.82점, 실행 기능을 나타내는 언어유창성 점수와 시계 그리기 점수는 각각 8.53점, 7.11점이었다(Table 2). 자율신경계 기능을 나타내는 심박변이도 지수들을 살펴보면, 심장 반응성을 나타내는 심박표준편차와 부교감신경 활성도를 나타내는 RMSSD의 경우 로그변환하여 분석하였는데, 각 로그변환 수치는 3.31과 2.83이었다. 부교감신경 활성도와 교감신경 활성도를 나타내는 주파수 영역의 지수인 nHF와 nLF는 각각 41.5%, 59.0%였고, LF/HF 비율은 2.81 a.u.로 나타났다. 타액 알파아밀라아제의 수치는 평균 69.51 U/mL이었다. 타액 코티졸 수치는 평균 5.01 nmol/L이었으나 타액 코티졸 수치는 정규분포를 보이지 않아 로그변환한 수치는 평균 1.43였다. 대상자들의 신체활동은 하루 평균 걸음 수가 4,499.22보였고 하루 평균 정적 활동 시간, 저강도 활동 시간, 중강도 활동 시간은 각각 753.93분, 290.61분, 22.74분이었으며, 중강도-고강도 활동시간은 23.12분이었다.
Table 2
Descriptive Statistics of Study Variables (N = 98)
3. 자율신경계 기능 및 타액 코티졸, 신체활동이 인지기능에 미치는 영향
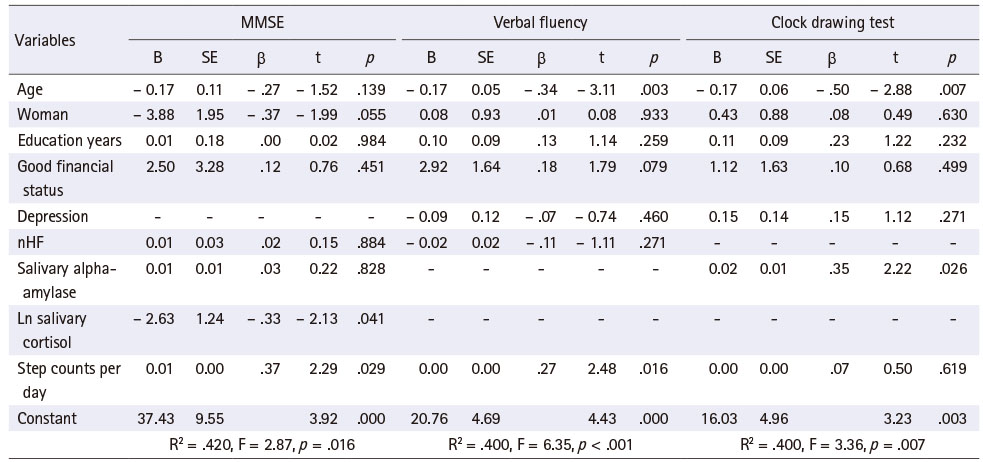
전반적인 인지기능을 나타내는 MMSE, 실행 기능을 반영하는 언어유창성, 시계 그리기 결과와 관련된 요인들을 각각 찾아내기 위해 다중선형회귀 분석을 시행하였다(Table 3). 잔차 분석 결과, 회귀모형은 모형의 선형성과 오차의 등분산성 및 정규성을 만족하였다. Durbin–Watson 지수는 2.16 (MMSE), 1.99 (언어유창성), 2.11 (시계 그리기)로 종속변수들은 자기상관성 없이 독립적이었다. 공차(tolerance)는 .44~.92로 .10 이상이었고 분산팽창지수(variance inflation factors)는 1.09~2.27으로 10 이하이므로 다중공선성의 문제는 없었다.
Table 3
Factors Influencing Cognitive Functions
전반적인 인지기능의 회귀모형은 유의하였고(F = 2.87, p = .016), 설명력은 42.0%를 보였다. 전반적인 인지기능에 유의한 영향을 미치는 요인은 타액 코티졸 수치, 하루 평균 걸음 수였으며 타액 코티졸 수치가 낮을수록(β = − .33, p = .041), 하루 평균 걸음 수가 많을수록(β = .37, p = .029) 전반적 인지기능이 좋았다. 그러나 부교감신경 활성도와 우울은 전반적인 인지기능에 유의한 영향을 미치지 않았다.
실행 기능 중 언어유창성의 회귀모형 역시 유의한 것으로 나타났고(F = 6.35, p < .001), 40.0%의 설명력을 보였다. 언어유창성 점수는 연령이 낮을수록(β = − .34, p = .003), 하루 평균 걸음수가 많을수록(β = .27, p = .016) 좋았다. 시계 그리기의 회귀모형도 유의하였고(F = 3.36, p = .007), 설명력은 40.0%였다. 시계 그리기 점수는 연령이 낮을수록(β = − .50, p = .007), 타액 알파아밀라아제 수치가 높을수록(β = .35, p = .026) 좋은 것으로 나타났다. 실행 기능 역시 부교감신경 활성도나 우울과 유의한 관련성을 보이지 않았다.
논 의
본 연구는 노인요양병원에 입원 중인 경도 인지장애 노인의 신체활동 양상을 웨어러블 센싱 기기를 이용하여 파악하고 자율신경계 기능 및 알파아밀라아제와 코티졸 수준을 조사하여 이들이 인지기능에 미치는 영향을 조사하기 위해 시행되었다.
본 연구에서 입원 노인들의 전체적인 활동량을 나타내는 하루 평균 걸음 수는 4,499.22보로 지역사회 거주 여성 노인들을 대상으로 한 연구에서 보고된 7,224보에 비해 매우 낮았다[31]. 일반적으로 건강한 노인들에게는 하루 2,000~9,000보, 장애가 있거나 만성질환이 있는 취약 노인들에게는 하루 1,200~8,800보의 활동량이 적절한 것으로 제시되고 있음을[32] 미루어 보아 입원 노인들은 건강한 지역사회 노인들에 비해서는 활동량이 적으나, 취약 노인들의 평균 활동량 정도는 유지하고 있는 것으로 볼 수 있겠다. 신체활동 강도의 측면을 보면, 하루 평균 정적 활동 시간이 753.93분으로 전체 활동의 70.0%를 차지하였고, 저강도의 신체활동 시간이 290.61분으로 27.8%, 중간 강도의 신체활동이 22.74분으로 2.2%를 차지하였으며, 고강도의 운동은 0분이었다. 이는 건강한 지역사회 거주 노인들의 각 신체활동이 65%, 32%, 2%인 것과 비교했을 때[33], 중강도 신체활동은 비슷한 수준이었으나 저강도 활동 시간의 비율이 낮고 정적 활동 시간 비율이 다소 높았다. 또한 경증-중간 정도의 파킨슨 질환을 가진 지역사회 거주 노인들의 신체활동을 조사한 선행연구에서 정적 활동 시간이 약 590분이었던 것과 비교했을 때에도 본 연구의 입원 노인들의 정적 활동 시간이 상당히 긴 것을 알 수 있었다[34]. 입원 노인들의 정적 활동 증가는 신체적 건강에 부정적인 영향을 미칠 수 있음을 고려할 때[35], 입원 노인들의 정적인 활동을 줄이기 위한 노력이 필요할 것으로 생각된다.
한편, 인지기능과 관련해서는 전체적인 활동량을 나타내는 하루 평균 걸음 수가 가장 큰 영향을 주는 것으로 나타나 선행연구와 유사하였다[36]. 그러나 선행연구에서는 전체적인 활동량보다는 중강도-고강도 활동(moderate-to-vigorous activity)과 같은 활동의 강도가 인지기능과 더 관련이 있는 것으로 보고되었다[37]. 선행연구에서는 주로 지역사회 거주하는 75세 이하의 연소 노인이 많았고 중강도-고강도 활동량이 다소 높았으며, 다변량 분석에서 인구학적 요인 정도만 투입하여 분석하여 본 연구와 차이가 있었다. 따라서 신체활동 강도가 그리 높지 않은 고령의 노인요양병원 입원 노인에서 인구학적 요인 및 생리적 요인까지 함께 분석했을 때에는 신체활동의 강도보다는 전체적인 신체활동량이 더 유의하게 인지기능에 영향을 주는 것으로 유추할 수 있겠다. 또한 본 연구에서 하루 평균 걸음 수는 실행 기능 중 시계 그리기 검사에는 유의한 영향을 미치지 않는 것으로 나타났는데, Aydin 등[38] 역시 시계 그리기 검사결과는 신체활동보다 햇빛노출이나 비타민 D, 심혈관 상태와 같은 생리적 요인과 유의하게 관련 있었다고 하여 본 연구와 유사하였다.
본 연구에서 부교감신경 활성을 나타내는 심박변이도 지표인 nHF는 인지기능에 유의한 수준의 영향을 미치지 않아 선행연구 결과와 상이하였고[19] NVI 모델을 지지하지 못하였다. NVI 모델은 기본적으로 인지기능이 정상인 성인이나 노인들을 대상으로 하여 개발되고 검증된 모델이며 선행연구에서도 자율신경계기능과 뇌혈류량의 관계는 성별이나 인종에 따라 다를 수 있음이 보고된 바 있다[39]. Allen 등[39]의 연구에 의하면 부교감신경 활성이 높은 경우에 뇌혈류량이 유의하게 저하되는 양상이 여성에서만 보였다고 하였는데, 본 연구에서도 여성의 전반적인 인지기능이 남성에 비해 낮았으며 유의수준이 경계 수준을 보였다. 이러한 성별이 전반적인 인지기능에 미치는 영향력은 평균 걸음 수와 타액 코티졸 수준에 이어 세 번째로 강한 양상을 보여 성별에 따라 인지기능과 자율신경계 기능과의 관련성이 다를 수 있을 것으로 추측할 수 있겠다. 또한 대상자들이 대부분 자율신경계나 인지기능에 퇴행성 변화가 심할 것으로 추측되는 고령의 노인들이며, 자율신경계에 영향을 줄 수 있는 다양한 약물을 섭취하고 있는 노인들이었던 점을 고려하면, 이러한 대상자들에게 NVI 모델을 적용하기 위해서는 NVI 모델이 확장 및 수정될 필요가 있을 것으로 생각된다. 본 연구에서 심박변이도와 인지기능간의 관련성을 좀 더 자세하게 살펴보면, nHF 수치는 전반적인 인지기능을 나타내는 MMSE에 정적인 영향을, 실행 기능을 나타내는 언어유창성 검사 결과에는 부적인 영향을 미치는 경향이 있었다. 전반적인 인지기능과 부교감신경의 활성 간의 이러한 관련성은 연령이나 인지기능이 본 연구 대상자들과 비슷한 노인을 대상으로 한 연구에서도 유사하게 보고된 바 있다[40]. 그러나 실행 기능과 부교감신경 활성 간의 관련성에 대해서는 관련성의 방향에 있어 선행연구들에서도 다소 상반된 결과를 보이고 있는데, Nonogaki 등[41]에 연구에서는 부교감신경 활성도는 유의하지는 않지만 실행 기능에 정적인 영향을 주었으나, Jennings 등[42]의 연구에서는 역시 유의한 수준은 아니었지만 부적인 영향을 미쳤다. 이러한 상반된 결과는 실행 기능이 부교감신경 활성도 뿐만 아니라 교감신경 활성도와도 관련이 있기 때문일 수 있을 것으로 생각된다. 실행 기능과 부교감신경 활성도의 관련성은 교감신경 활성도가 높은 사람에서는 다르게 나타날 수 있는데[43], 본 연구 대상자들의 LF/HF 비율은 2.81로 Nonogaki 등[41]의 대상자들의 1.5에 비해 높아 교감신경 활성도가 부교감신경 활성도에 비해 높은 편이었기 때문에 상반된 결과를 보였을 가능성이 있다. 실제로 본 연구 결과에서 실행 기능 검사인 시계 그리기 검사 결과는 교감신경계의 활성을 반영하는 타액 알파아밀라아제 수준이 높은 경우에 점수가 유의하게 높은 것으로 나타난 바 있고, 선행연구에서도 약간의 심리적 스트레스나 간단한 신체활동과 함께 동반된 교감신경 활성도 증가는 실행 기능의 증가와 연관이 있는 것으로 보고된 바 있다[44, 45]. 따라서 실행 기능은 교감신경계의 활성이 어느 정도 유지되고 부교감신경 활성은 다소 낮은 경우 잘 발휘될 수 있을 것으로 보이며, 추후에는 교감신경을 활성화시킬 수 있는 인지자극을 제공하고 실행 기능에 어떠한 영향을 주는지 조사하는 연구가 필요할 것으로 생각된다.
HPA axis의 말단에서 분비되는 코티졸 또한 전반적인 인지기능에 유의한 영향을 주었는데, 코티졸 수치가 높을수록 전반적인 인지기능은 유의하게 낮았다. 선행연구들에 의하면 정상 또는 경도인지장애 노인에서는 코티졸 수준과 인지기능과의 관련성에 대한 연구 결과가 다소 상반되고 있음에도 불구하고[46, 47] 본 연구에서 유의한 관련성이 보인 것에 주목할 필요가 있다. 타액코티졸의 증가는 신체적 허약이나 우울 및 스트레스 환경과도 관련이 있는 것으로 알려져 있는데[48, 49], 본 연구의 대상자들인 노인요양병원 입원 노인들은 이러한 조건을 가지고 있는 경우가 많기 때문에 증가된 코티졸 수준이 인지기능에 유의한 영향을 미치는 것으로 나타났을 수 있다. 실제로 선행연구에서 나타난 로그변환 코티졸 수치인 1.2에 비해 본 연구 대상자들의 코티졸 수치는 1.43로 다소 높았고 우울감 수준도 높은 편이었다. 또한 본 연구에서 코티졸 수치는 실행 기능에는 유의한 영향을 주지않았는데, 증가된 코티졸은 뇌에서 기억을 담당하는 해마의 기능장애와 관련되므로[50] 실행 기능보다는 주로 기억능력 평가가 포함되어 있는 전반적 인지기능에 영향을 주었던 것으로 생각된다.
본 연구의 제한점으로는 첫째, 일반적으로 지역사회 거주 대상자들에게는 7일간 액티그래프를 착용하게 하는데 비해 본 연구 대상자들은 3~4일간 액티그래프를 착용하였던 점이다. 그러나 착용 시간 분석 결과, 실제 착용 시간이 평균 3.3일로 비교적 높은 착용률을 보였고, 노인요양병원 입원 대상자들은 다양한 신체활동에 참여하기 어려운 상황임을 고려할 때, 3~4일간 착용하여 얻은 액티그래프 신체활동 자료도 이들의 일상적인 신체활동을 어느 정도 반영할 수 있을 것으로 보인다. 두 번째로 심박변이도 측정이 5분간 1회로 짧았던 점이다. 본 연구를 기반으로 추후에는 웨어러블 심박변이도 기기를 이용하여 심박변이도를 일정 기간 동안 측정하고, 동시에 수집된 다양한 관련 변수들과 함께 분석하는 생태 순간 평가(ecological momentary assessment) 연구가 진행될 수 있을 것으로 생각된다. 마지막으로 본 연구의 대상자 수가 많지 않았던 점이다. 인지기능이나 심박변이도는 성별에 따른 차이도 나타나므로 추후 연구에서는 더 많은 대상자들을 확보하여 성별에 따른 분석을 시행할 것을 제언한다.
결 론
본 연구에서 노인요양병원에 입원 중인 경도 인지장애 노인들의 전체적인 신체활동량은 만성질환 노인들의 수준과 유사하였으나, 정적 활동의 비율은 높은 편이었다. 신체활동은 인지기능과 유의하게 관련되었는데, 전체적인 활동량이 높을수록 인지기능이 양호하였다. 또한 타액 코티졸 수준이 높을수록 전반적인 인지기능이 낮았고, 타액 알파아밀라아제 수준이 높을수록 실행기능이 높았다. 그러나 안정시 부교감신경 활성도는 인지기능에 유의한 영향을 미치지 않아 본 연구에서 NVI 모델은 지지되지 않았다.
본 연구 결과를 토대로 다음과 같은 전략을 제언한다. 노인요양병원에 입원 중인 경도인지 장애 노인의 오전 코티졸 수준이 높은 경우 인지기능이 취약했으므로, 이들의 오전 코티졸 수준을 낮추려는 노력이 필요하다. 또한 이들이 치매로 이환되는 것을 예방하기 위해서 신체활동의 강도를 높이기보다는 정적 활동량을 줄이고 전체적인 활동량을 높이는 전략을 취할 것을 제안하며, 복합적인 실행 기능을 증진시키기 위해서는 적절한 교감신경계 활성을 유지시키는 것이 도움이 될 수 있겠다. 또한 노인요양병원에 입원 중인 경도 인지장애 노인들의 인지기능과 자율신경계 기능의 관련성에 있어 부교감신경 활성도 외에도 알파아밀라아제 수치와 같은 교감신경계의 역할을 중요하게 고려하여 NVI 모델을 보완할 필요가 있다.
CONFLICTS OF INTEREST:The author declared no conflict of interest.
FUNDING:This study was supported by a grant from the National Research Foundation of Korea (No. NRF-2018R1C1B5042045).
ACKNOWLEDGEMENTS
None.
DATA SHARING STATEMENT
Please contact the corresponding author for data availability.
References
-
González-Colaço Harmand M, Meillon C, Rullier L, Avila-Funes JA, Bergua V, Dartigues JF, et al. Cognitive decline after entering a nursing home: A 22-year follow-up study of institutionalized and noninstitutionalized elderly people. Journal of the American Medical Directors Association 2014;15(7):504–508. [doi: 10.1016/j.jamda.2014.02.006]
-
-
Maseda A, Balo A, Lorenzo-López L, Lodeiro-Fernández L, Rodríguez-Villamil JL, Millán-Calenti JC. Cognitive and affective assessment in day care versus institutionalized elderly patients: A 1-year longitudinal study. Clinical Interventions in Aging 2014;9:887–894. [doi: 10.2147/CIA.S63084]
-
-
Thayer JF, Hansen AL, Saus-Rose E, Johnsen BH. Heart rate variability, prefrontal neural function, and cognitive performance: The neurovisceral integration perspective on self-regulation, adaptation, and health. Annals of Behavioral Medicine 2009;37(2):141–153. [doi: 10.1007/s12160-009-9101-z]
-
-
Daimiel L, Martínez-González MA, Corella D, Salas-Salvadó J, Schröder H, Vioque J, et al. Physical fitness and physical activity association with cognitive function and quality of life: Baseline cross-sectional analysis of the PREDIMED-Plus trial. Scientific Reports 2020;10(1):3472 [doi: 10.1038/s41598-020-59458-6]
-
-
Han JW, Kim TH, Jhoo JH, Park JH, Kim JL, Ryu SH, et al. A normative study of the Mini-Mental State Examination for Dementia Screening (MMSE-DS) and its short form(SMMSE-DS) in the Korean elderly. Journal of Korean Geriatric Psychiatry 2010;14(1):27–37.
-
-
Jessen F, Wolfsgruber S, Wiese B, Bickel H, Mösch E, Kaduszkiewicz H, et al. AD dementia risk in late MCI, in early MCI, and in subjective memory impairment. Alzheimer's & Dementia 2014;10(1):76–83. [doi: 10.1016/j.jalz.2012.09.017]
-
-
Universität Düsseldorf. G*Power [Internet]. Düsseldorf: Heinrich-Heine-Universität Düsseldorf; c2020 [cited 2020 Feb 20].Available from: https://www.gpower.hhu.de.
-
-
Sadeghipour Roodsari M, Akbari Kamrani AA, Foroughan M, Mohammadi F, Karimloo M. Validity and reliability of the clock drawing test in older people. Salmand: Iranian Journal of Ageing 2013;8(2):48–53.
-
-
Adams J, Julian P, Hubbard M, Hartman J, Baugh S, Segrest W, et al. A randomized controlled trial of a controlled breathing protocol on heart rate variability following myocardial infarction or coronary artery bypass graft surgery. Clinical Rehabilitation 2009;23(9):782–789. [doi: 10.1177/0269215509334834]
-
-
Beltzer EK, Fortunato CK, Guaderrama MM, Peckins MK, Garramone BM, Granger DA. Salivary flow and alpha-amylase: Collection technique, duration, and oral fluid type. Physiology & Behavior 2010;101(2):289–296. [doi: 10.1016/j.physbeh.2010.05.016]
-
-
Kee BS. A preliminary study for the standardization of geriatric depression scale short form-Korea version. Journal of the Korean Neuropsychiatric Association 1996;35(2):298–307.
-
-
Lee GR, Kim DR, Lim HN, Kang KH. The effects of the oral care program for improving swallowing function of the elderly using welfare centers on depression, self efficacy, subjective oral health status and swallowing related quality of life. Journal of Korean Academy of Community Health Nursing 2020;31(2):166–178. [doi: 10.12799/jkachn.2020.31.2.166]
-
-
Ortlieb S, Gorzelniak L, Nowak D, Strobl R, Grill E, Thorand B, et al. Associations between multiple accelerometry-assessed physical activity parameters and selected health outcomes in elderly people: Results from the KORA-age study. PLoS One 2014;9(11):e111206 [doi: 10.1371/journal.pone.0111206]
-
-
Benka Wallén M, Franzén E, Nero H, Hagströmer M. Levels and patterns of physical activity and sedentary behavior in elderly people with mild to moderate Parkinson disease. Physical Therapy 2015;95(8):1135–1141. [doi: 10.2522/ptj.20140374]
-
-
Lobo A, Santos P, Carvalho J, Mota J. Relationship between intensity of physical activity and health-related quality of life in Portuguese institutionalized elderly. Geriatrics & Gerontology International 2008;8(4):284–290. [doi: 10.1111/j.1447-0594.2008.00478.x]
-
-
Wu ZJ, Wang ZY, Hu BQ, Zhang XH, Zhang F, Wang HL, et al. Relationships of accelerometer-based measured objective physical activity and sedentary behaviour with cognitive function: A comparative cross-sectional study of China's elderly population. BMC Geriatrics 2020;20(1):149 [doi: 10.1186/s12877-020-01521-y]
-
-
Aydin ZD, Ersoy IH, Baştürk A, Kutlucan A, Göksu SS, Güngör G, et al. Predictors of clock drawing test (CDT) performance in elderly patients attending an internal medicine outpatient clinic: A pilot study on sun exposure and physical activity. Archives of Gerontology and Geriatrics 2011;52(3):e226–e231. [doi: 10.1016/j.archger.2010.11.018]
-
-
Nonogaki Z, Umegaki H, Makino T, Suzuki Y, Kuzuya M. Relationship between cardiac autonomic function and cognitive function in Alzheimer's disease. Geriatrics & Gerontology International 2017;17(1):92–98. [doi: 10.1111/ggi.12679]
-
-
Lin F, Heffner K, Mapstone M, Chen DG, Porsteisson A. Frequency of mentally stimulating activities modifies the relationship between cardiovascular reactivity and executive function in old age. The American Journal of Geriatric Psychiatry 2014;22(11):1210–1221. [doi: 10.1016/j.jagp.2013.04.002]
-
-
Johar H, Emeny RT, Bidlingmaier M, Lacruz ME, Reincke M, Peters A, et al. Lower morning to evening cortisol ratio is associated with cognitive impairment in men but not women: An analysis of 733 older subjects of the cross-sectional KORA-Age study. Psychoneuroendocrinology 2015;51:296–306. [doi: 10.1016/j.psyneuen.2014.10.011]
-
 KSNS
KSNS
 E-SUBMISSION
E-SUBMISSION

 Cite
Cite